Hipoglikemia reaktywna to zaburzenie regulacji poziomu glukozy we krwi (tzw. glikemii), objawiające się nagłym „zjazdem” energii, drżeniem rąk, kołataniem serca czy silnym głodem. Typowo występuje od 1 do 5 godzin po posiłku, dlatego bywa też nazywana hipoglikemią poposiłkową. Choć nie jest samodzielną chorobą, może znacząco obniżać komfort i jakość życia. W tym artykule wyjaśniamy, na czym polega hipoglikemia reaktywna, jak ją rozpoznać (np. na podstawie Triady Whipple’a) i kiedy warto wykonać test obciążenia glukozą. Dowiesz się również, jak przebiega diagnostyka, leczenie i przede wszystkim – jak powinna wyglądać dieta. Pokażemy Ci, co jeść, a czego unikać, by ustabilizować poziom cukru oraz przedstawimy praktyczny jadłospis i zamienniki produktów. Wytłumaczymy też, jak działa dieta o niskim indeksie i ładunku glikemicznym, z odpowiednią ilością białka, błonnika i właściwym rytmem posiłków. Dzięki temu zrozumiesz, jak ułożyć menu, które ograniczy nagłe spadki glikemii, pomoże odzyskać energię i przywróci sprawczość w ciągu dnia.
Autorzy: mgr inż. Klaudia Buczek, mgr farm. Michał Miśta, lic. Jakub Rutana
Spis treści:
- Hipoglikemia reaktywna – co to jest?
- Jakie są objawy hipoglikemii reaktywnej?
- Rola insuliny w hipoglikemii reaktywnej
- Przyczyny hipoglikemii reaktywnej
- Nadmierne działanie insuliny
- Insulinooporność i wczesna faza cukrzycy typu 2
- Zaburzenia motoryki przewodu pokarmowego
- GLP-1 a ryzyko hipoglikemii reaktywnej
- Zwiększona wrażliwość tkanek na działanie insuliny
- Glukozuria nerkowa a hipoglikemia reaktywna
- Helicobacter pylori a ryzyko hipoglikemii reaktywnej
- Czynniki ryzyka hipoglikemii reaktywnej
- Idiopatyczna hipoglikemia reaktywna – na czym polega?
- Zaburzona odpowiedź przeciwhipoglikemiczna – co to oznacza?
- Hipoglikemia reaktywna – współdziałanie wielu mechanizmów
- Jak zdiagnozować hipoglikemię reaktywną?
- Hipoglikemia reaktywna a inne choroby
- Leczenie i styl życia w hipoglikemii reaktywnej
- Hipoglikemia reaktywna – zapobieganie
- Dieta w hipoglikemii reaktywnej
- Hipoglikemia reaktywna – co jeść?
- Hipoglikemia reaktywna a regularność posiłków – jak często jeść?
- Kompozycja posiłków w hipoglikemii reaktywnej
- Sposób obróbki termicznej i dojrzałość produktów — na co zwracać uwagę?
- Kolejność jedzenia a hipoglikemia reaktywna – prosty sposób na stabilniejszą glikemię
- Na co uważać w diecie przy hipoglikemii reaktywnej?
- Czym słodzić przy hipoglikemii reaktywnej?
- Zasady zdrowego odżywiania w hipoglikemii reaktywnej
- Dieta o niskim indeksie glikemicznym (IG) w hipoglikemii reaktywnej
- Dieta śródziemnomorska a hipoglikemia reaktywna
- Przykładowy jadłospis w hipoglikemii reaktywnej
- Hipoglikemia reaktywna w szczególnych sytuacjach
- Podsumowanie
- Bibliografia
- FAQ
1. Hipoglikemia reaktywna – co to jest?
Hipoglikemia reaktywna to spadek poziomu glukozy we krwi po jedzeniu poniżej 70 mg/dl (3,9 mmol/l) w ciągu 1–5 godzin po posiłku, najczęściej bogatym w węglowodany. Może występować zarówno u osób zdrowych, jak i z cukrzycą i objawia się m.in. osłabieniem, poceniem się, kołataniem serca czy zawrotami głowy. Po raz pierwszy została opisana w 1924 roku przez Seale’a Harrisa, amerykańskiego lekarza i profesora medycyny klinicznej na University of Alabama [1].
Lekarze opierają rozpoznanie hipoglikemii reaktywnej na tzw. triadzie Whipple’a [2] – to trzy warunki, które muszą pojawić się jednocześnie, by potwierdzić jej występowanie. Szczegółowo omawiamy je w Rozdziale 5: Jak zdiagnozować hipoglikemię reaktywną.
Warto podkreślić, że hipoglikemia reaktywna nie jest samodzielną chorobą, lecz objawem zaburzeń w regulacji poziomu cukru we krwi po posiłkach. Choć u wielu osób jej przebieg jest łagodny, częste epizody mogą wpływać negatywnie na codzienne funkcjonowanie – powodując zmęczenie, drażliwość oraz pogorszenie koncentracji i pamięci. W niektórych przypadkach hipoglikemia reaktywna może być również wczesnym sygnałem ostrzegawczym rozwoju insulinooporności lub cukrzycy typu 2 [3].
Ile czasu po posiłku występuje hipoglikemia reaktywna?
Objawy niedocukrzenia pojawiają się w określonym czasie po jedzeniu, w zależności od mechanizmu odpowiedzialnego za spadek poziomu glukozy. Na podstawie czasu wystąpienia objawów wyróżniamy:
- Wczesną hipoglikemię reaktywną, która pojawia się w ciągu pierwszych 2 godzin po posiłku. Często jest związana z przyspieszonym opróżnianiem żołądka, co prowadzi do gwałtownego wzrostu stężenia glukozy we krwi, a w konsekwencji – do nadmiernej i szybkiej odpowiedzi insulinowej. Taki mechanizm może być szczególnie widoczny u osób po zabiegach chirurgicznych w obrębie przewodu pokarmowego, np. po częściowej resekcji żołądka czy operacjach bariatrycznych.
- Późną hipoglikemię reaktywną, która występuje między 3 a 5 godziną po posiłku. Ten typ hipoglikemii jest częściej obserwowany u osób z nieprawidłową tolerancją glukozy, insulinoopornością lub zaburzeniami w zakresie wydzielania insuliny. Organizm produkuje wówczas zbyt dużo insuliny w stosunku do rzeczywistego zapotrzebowania, co prowadzi do nadmiernego obniżenia poziomu cukru we krwi.
Pamiętaj, że czas wystąpienia objawów może się różnić w zależności od wielu czynników – rodzaju i składu posiłku (szczególnie zawartości węglowodanów prostych), indywidualnej wrażliwości na insulinę oraz ogólnego stanu metabolicznego organizmu.
Hipoglikemia reaktywna a hipoglikemia poposiłkowa (różnice w nazewnictwie)
W literaturze i w praktyce medycznej można spotkać się z dwoma określeniami: hipoglikemia reaktywna oraz hipoglikemia poposiłkowa. Oba odnoszą się do tego samego zjawiska – spadku stężenia glukozy we krwi po posiłku – i często są używane zamiennie.
- Hipoglikemia reaktywna – podkreśla mechanizm reakcji organizmu na spożycie posiłku, który prowadzi do nadmiernego wyrzutu insuliny i późniejszego spadku cukru.
- Hipoglikemia poposiłkowa – akcentuje moment wystąpienia zaburzenia, czyli okres 1–5 godzin po jedzeniu, kiedy objawy pojawiają się najczęściej.
Z praktycznego punktu widzenia oba terminy oznaczają tę samą jednostkę kliniczną. W publikacjach naukowych częściej stosuje się określenie hipoglikemia reaktywna, natomiast w języku potocznym i niektórych źródłach popularnonaukowych spotyka się częściej termin hipoglikemia poposiłkowa.
2. Jakie są objawy hipoglikemii reaktywnej?
Objawy hipoglikemii reaktywnej występują w postaci tzw. epizodów, czyli krótkotrwałych, ale powtarzalnych spadków poziomu glukozy po posiłku. Epizody hipoglikemii reaktywnej pojawiają się najczęściej po spożyciu posiłków bogatych w łatwo przyswajalne węglowodany, czyli takie, które powodują szybki wzrost, a następnie nagły spadek glukozy we krwi. Warto podkreślić, że hipoglikemia reaktywna nie występuje na czczo ani w trakcie wysiłku fizycznego. Jej charakterystyczną cechą jest pojawianie się objawów wyłącznie po posiłkach, zwykle w ciągu kilku godzin, w wyniku zaburzonej odpowiedzi metabolicznej na spożytą glukozę.
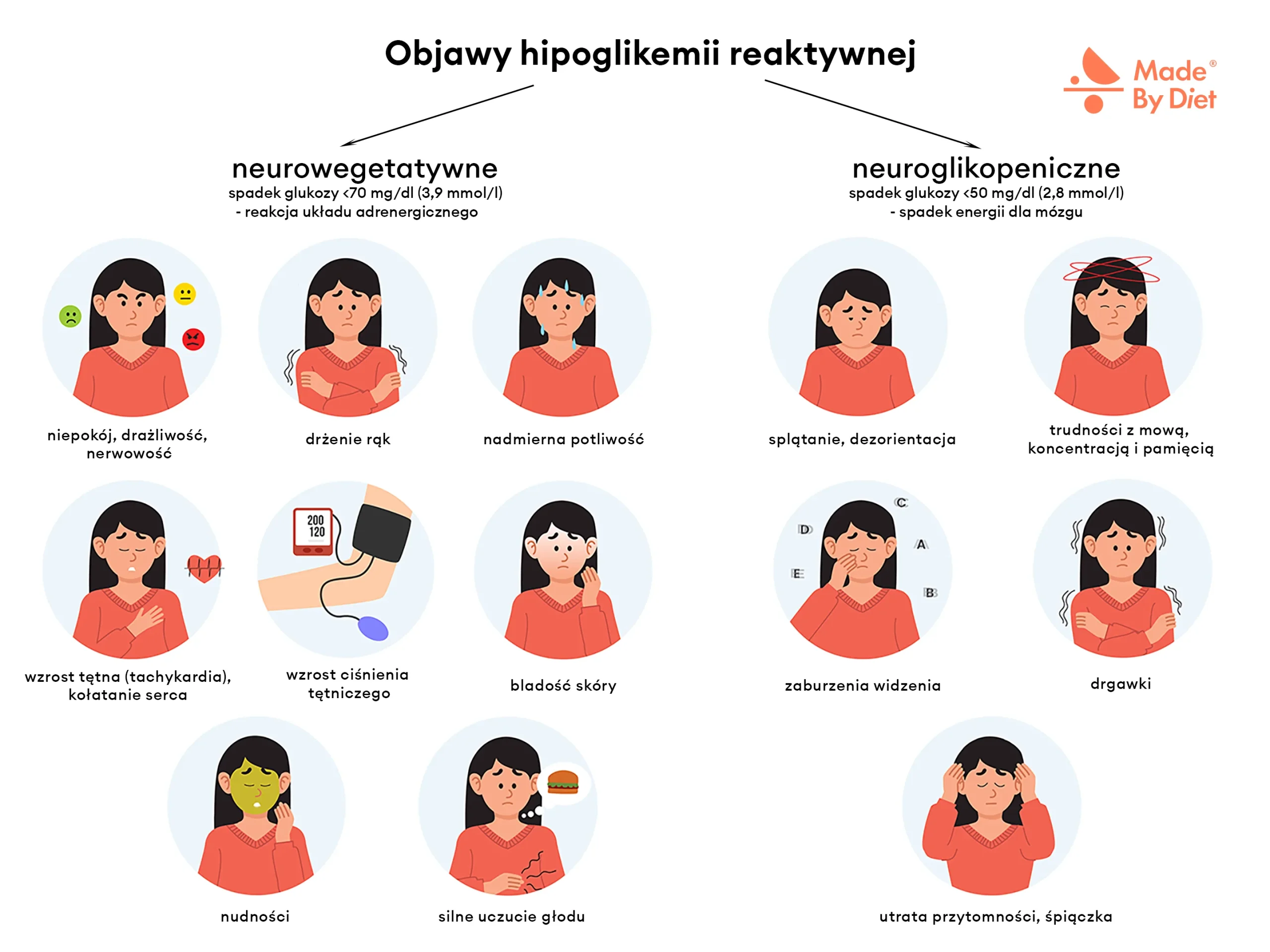
Objawy niedocukrzenia po jedzeniu dzieli się, w zależności od nasilenia hipoglikemii i jej wpływu na organizm, na dwie główne grupy: neurowegetatywne i neuroglikopeniczne.
Objawy neurowegetatywne hipoglikemii reaktywnej (adrenergiczne)
Występujuą zwykle przy spadku poziomu glukozy we krwi poniżej 70 mg/dl. Są wynikiem aktywacji układu współczulnego (adrenergicznego) i zwiększonego wydzielania katecholamin – czyli hormonów stresu, takich jak adrenalina i noradrenalina. Ich zadaniem jest szybka mobilizacja organizmu i przywrócenie równowagi glukozowej.
Do najczęstszych objawów należą m.in.:
- niepokój, drażliwość, nerwowość
- drżenie rąk
- nadmierna potliwość
- wzrost tętna (tachykardia), kołatanie serca
- wzrost ciśnienia tętniczego
- bladość skóry
- nudności
- silne uczucie głodu
Objawy neuroglikopeniczne hipoglikemii reaktywnej
Pojawiają się, gdy stężenie glukozy we krwi spada poniżej 50 mg/dl, a mózg nie otrzymuje wystarczającej ilości energii. Stan ten określa się jako neuroglikopenię.
Do typowych objawów należą:
- splątanie i dezorientacja,
- trudności z koncentracją, pamięcią i mową,
- zaburzenia widzenia (np. zamazane widzenie),
- w cięższych przypadkach: drgawki, utrata przytomności, a nawet śpiączka.
Choć objawy te zwykle występują przy głębszej hipoglikemii (wspomniane <50 mg/dl), mogą pojawić się także wcześniej, zwłaszcza jeśli spadek poziomu cukru jest gwałtowny lub organizm reaguje wyjątkowo wrażliwie.
Rysunek 1. Objawy hipoglikemii reaktywnej dzielą się na neurowegetatywne (wynik reakcji adrenergicznej) i neuroglikopeniczne (spowodowane niedoborem energii dla mózgu). Objawy te ustępują po spożyciu węglowodanów – to element tzw. triady Whipple’a.
Czym grozi spadek poziomu glukozy po posiłku?
Choć objawy hipoglikemii reaktywnej nie zawsze są dramatyczne, mogą mieć poważne konsekwencje w codziennych sytuacjach – np. podczas prowadzenia samochodu, pracy na wysokości, obsługi maszyn czy podejmowania ważnych decyzji. Utrata przytomności, dezorientacja czy spowolnione reakcje stanowią realne zagrożenie – nie tylko dla osoby doświadczającej epizodu, ale również dla jej otoczenia.
Dlatego hipoglikemii reaktywnej nie należy bagatelizować, nawet jeśli objawy wydają się „tylko” irytujące czy przejściowe. Regularne epizody mogą być sygnałem zaburzeń metabolicznych i wymagają oceny lekarskiej oraz zmian w stylu życia – zwłaszcza w diecie i rytmie posiłków.
Jak hipoglikemia reaktywna wpływa na samopoczucie?
Wahania poziomu glukozy po posiłkach mogą wywoływać nie tylko objawy fizyczne, ale również psychiczne. U wielu osób, oprócz klasycznego głodu czy drżenia rąk, pojawiają się:
- nagłe spadki energii i przewlekłe zmęczenie,
- trudności z koncentracją i uczucie „mgły umysłowej”,
- wahania nastroju, drażliwość, lęk czy obniżony nastrój przypominający symptomy depresji.
W życiu codziennym może to prowadzić do wycofania, utraty motywacji i problemów w komunikacji z innymi. Objawy te wynikają z fizjologicznej reakcji organizmu na gwałtowny spadek poziomu cukru we krwi i mogą wyraźnie pogarszać jakość życia – zarówno zawodowego, jak i prywatnego.
Jeśli rozpoznajesz u siebie te objawy, skonsultuj się ze specjalistą. Podczas konsultacji doświadczony dietetyk kliniczny przeanalizuje Twoją sytuację i wyniki badań laboratorynych oraz zaproponuje indywidualną dietoterapię, która pomoże ustabilizować glikemię.
Umów się na konsultację z dietetykiem klinicznym
3. Rola insuliny w hipoglikemii reaktywnej
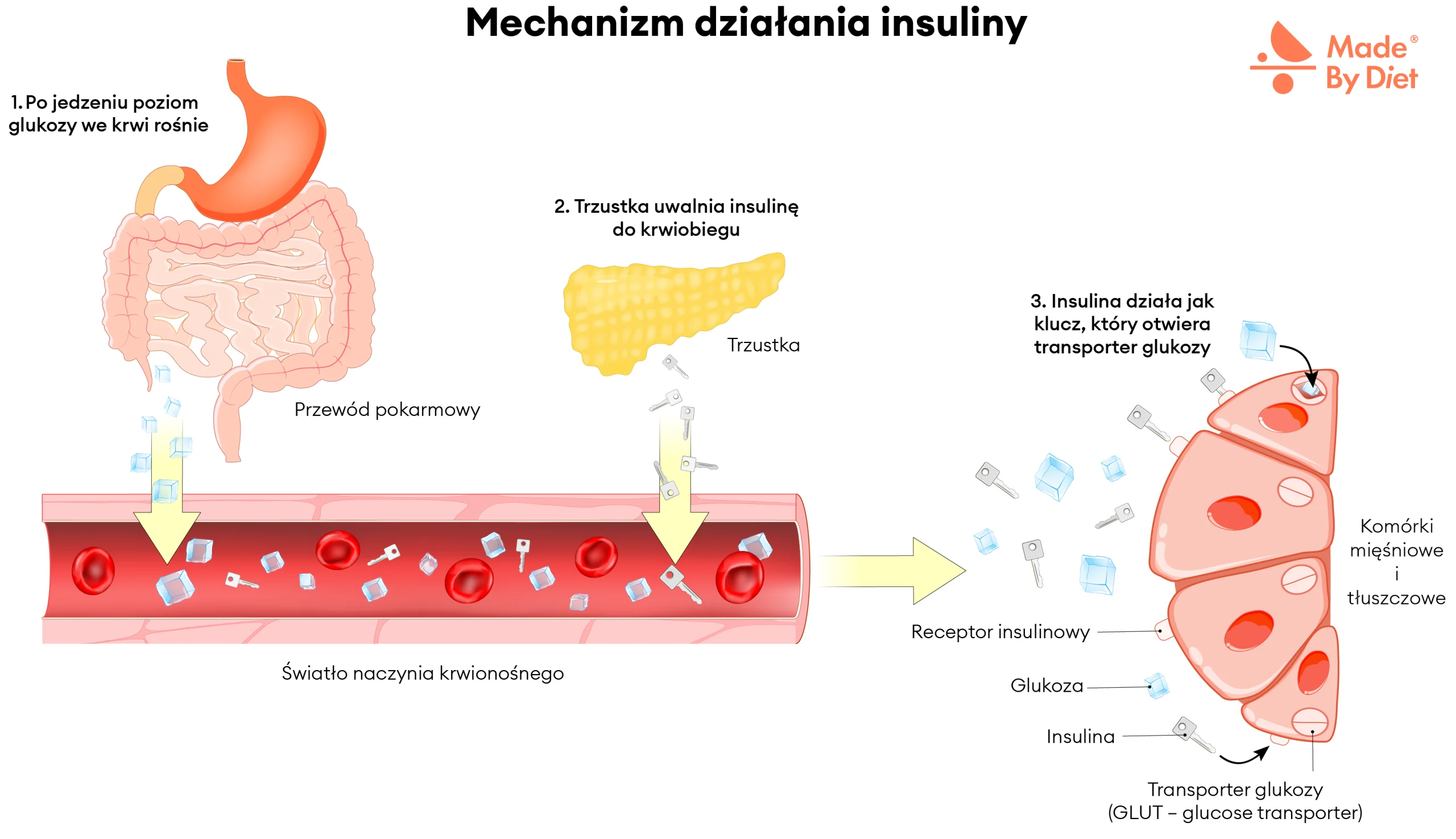
Żeby zrozumieć, skąd bierze się hipoglikemia reaktywna, trzeba poznać, jak działa insulina – hormon, który po posiłku obniża poziom glukozy we krwi. Razem z glukagonem, hormonem produkowanym w tym samym organie – trzustce, tworzy duet odpowiedzialny za utrzymanie prawidłowego stężenia glukozy. Insulina zmniejsza jej poziom, a glukagon go zwiększa, co pozwala zachować równowagę – stabilną glikemię, zapewniającą stały dopływ energii z węglowodanów do komórek.
Kiedy posiłek trafia do przewodu pokarmowego, zawarte w nim węglowodany złożone są rozkładane do glukozy, która wchłania się w jelicie cienkim i przechodzi do krwiobiegu. Wzrost stężenia glukozy działa jak sygnał dla komórek β trzustki, które rozpoczynają wydzielanie insuliny. Hormon ten ułatwia transport glukozy do wnętrza komórek mięśni, wątroby i tkanki tłuszczowej, gdzie może być wykorzystana do produkcji energii lub zmagazynowana na później. Dzięki temu poziom glukozy we krwi stopniowo spada do wartości prawidłowych.
Rysunek 2. Mechanizm działania insuliny. Po posiłku poziom glukozy we krwi rośnie, a trzustka uwalnia insulinę. Hormon ten działa jak „klucz”, który otwiera transportery glukozy (GLUT) w komórkach mięśniowych i tłuszczowych. Dzięki temu glukoza może dostać się do wnętrza komórek i zostać wykorzystana jako źródło energii. To podstawowy mechanizm regulacji stężenia glukozy we krwi, chroniący organizm przed zbyt dużymi wahaniami cukru.
Dwufazowe wydzielanie insuliny po posiłku
Wydzielanie insuliny po posiłku przebiega dwufazowo. Pierwsza faza to szybki wyrzut insuliny, który pojawia się w ciągu kilku minut po wzroście glikemii i pozwala błyskawicznie obniżyć poziom cukru we krwi. Druga faza rozwija się wolniej, ale trwa dłużej – przez kolejne godziny po posiłku, szczególnie jeśli był on bogaty w węglowodany o wysokim indeksie glikemicznym.
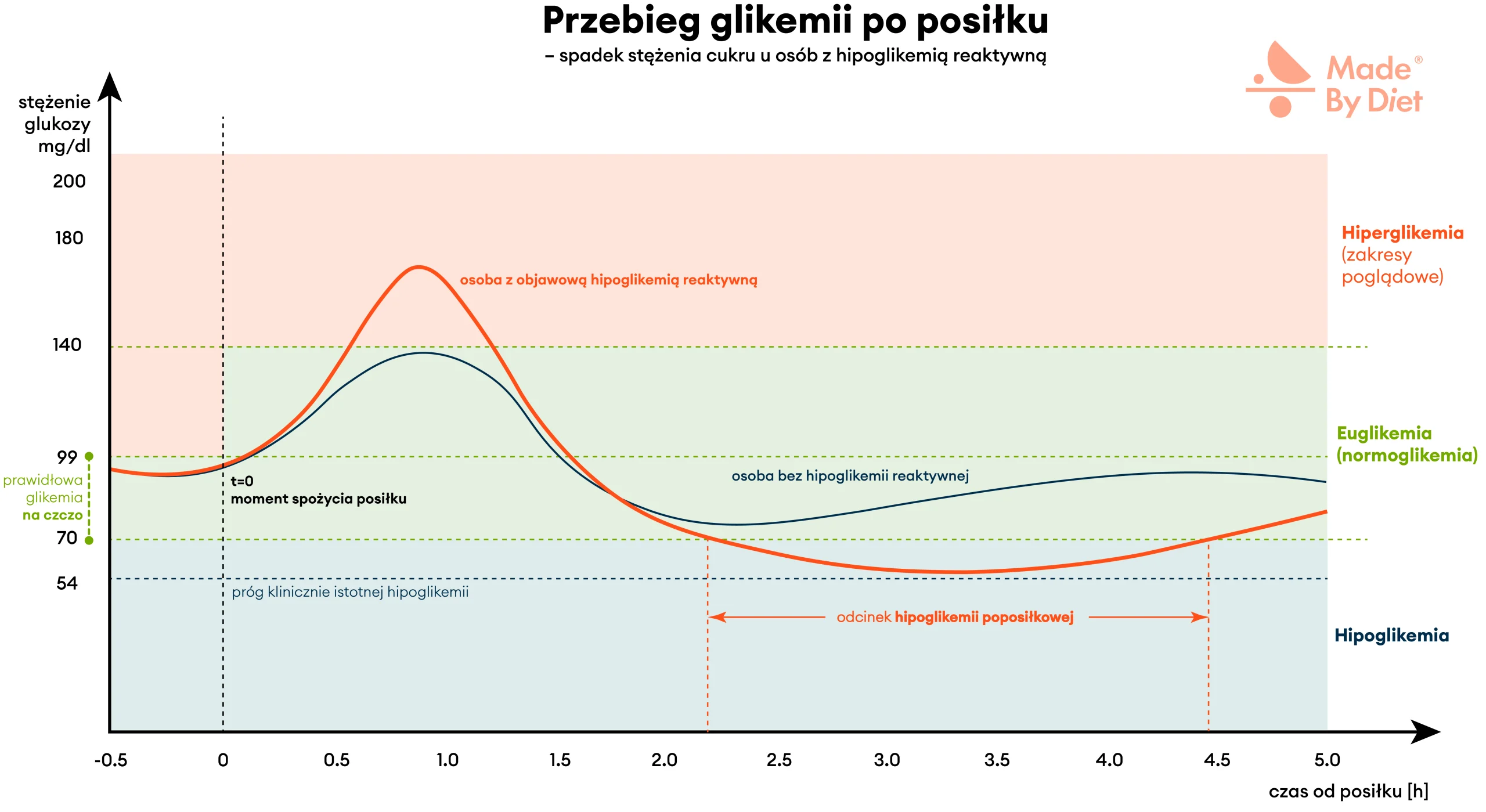
W hipoglikemii reaktywnej dochodzi do zaburzenia fizjologicznej dynamiki dwufazowego wydzielania insuliny: często osłabia się faza pierwsza, a faza druga jest opóźniona, nadmiernie nasilona i/lub przedłużona. Równocześnie odpowiedź glukagonowa bywa niewystarczająca, dlatego po początkowym, wyższym wzroście glikemii może dojść do nadmiernego obniżenia stężenia glukozy. Najczęściej dzieje się to 1–5 godzin po posiłku, czasem nawet poniżej wartości obserwowanych na czczo. Mówiąc bardziej obrazowo — najpierw cukier „skacze” w górę, a potem spada zbyt mocno.
Poposiłkowy spadek glikemii i kontrregulacja
W opisanym wyżej wzorcu odpowiedzi hormonalnej, w okresie 1–5 godzin po posiłku, poziom glukozy może spaść poniżej 70 mg/dl, a sporadycznie poniżej 54 mg/dl. Próg 70 mg/dl traktujemy jako sygnał ostrzegawczy, a 54 mg/dl jako klinicznie istotną hipoglikemię wymagającą pilnej korekty węglowodanami. To właśnie wtedy wiele osób odczuwa charakterystyczny „zjazd energii” i pojawiają się typowe objawy niskiego cukru. Z kolei próg około 50 mg/dl wiąże się z początkiem objawów neuroglikopenicznych — przy tak niskim stężeniu glukozy mózg zaczyna realnie „odczuwać brak paliwa” (→ zob. Rozdział 2: Jakie są objawy hipoglikemii reaktywnej?).
W odpowiedzi na niskie stężenie glukozy organizm uruchamia kontrregulację — zwiększa wydzielanie glukagonu, adrenaliny i hormonu wzrostu. Hormony te nasilają glikogenolizę (uwalnianie glukozy z glikogenu) i glukoneogenezę (wytwarzanie glukozy z innych substratów), co zwykle pomaga wrócić do normoglikemii. To adaptacja podobna do reakcji na przedłużający się post, choć może dawać nieprzyjemne objawy „stresowe”, np. kołatanie serca czy niepokój.
Rysunek 3. Przebieg glikemii po posiłku u osoby bez hipoglikemii reaktywnej (cienka granatowa linia) i u osoby z hipoglikemią reaktywną (pogrubiona czerwona linia). U osoby bez hipoglikemii reaktywnej glikemia po posiłku rośnie łagodnie (szczyt po 30–60 min) i wraca do wartości prawidłowych bez spadku poniżej 70 mg/dl. U osoby z hipoglikemią reaktywną, po większym wstępnym wzroście glikemii, między 2. a 5. godziną po posiłku dochodzi zwykle do spadku poniżej 70 mg/dl (czasem poniżej 54 mg/dl), co wynika z opóźnionej i/lub nadmiernej odpowiedzi insulinowej.
Hipoglikemia reaktywna pokazuje, jak niewielkie zaburzenia w subtelnym balansie hormonalnym mogą prowadzić do wyraźnych objawów klinicznych. Insulina, której zadaniem jest stabilizacja poziomu glukozy, przy zbyt wysokim i przedłużonym stężeniu staje się źródłem problemu. Zamiast wspierać organizm, pogłębia spadek glikemii, powodując niedocukrzenie i uruchamiając reakcję stresową.
Świadomość tego mechanizmu jest pierwszym krokiem do modyfikacji diety i stylu życia, które pomagają w zapobieganiu hipoglikemii reaktywnej i odzyskaniu energii. Więcej praktycznych wskazówek znajdziesz w Rozdziale 8: Hipoglikemia reaktywna – zapobieganie oraz Rozdziale 9: Dieta w hipoglikemii reaktywnej.
4. Przyczyny hipoglikemii reaktywnej
W poprzednim rozdziale (→ zob. Rozdział 3: Rola insuliny w hipoglikemii reaktywnej) wyjaśnialiśmy, dlaczego nadmierne wydzielanie insuliny odgrywa kluczową rolę w tym zaburzeniu. Teraz czas przyjrzeć się bliżej mechanizmom, które do tego prowadzą.
U większości osób występowanie hipoglikemii reaktywnej obserwuje się 3–5 godzin po posiłku. Zamiast stabilizacji poziomu cukru dochodzi wtedy do jego gwałtownego spadku. Przyczyny nie zawsze są jednoznaczne, ale badacze wyróżniają kilka najważniejszych scenariuszy.
Nadmierne działanie insuliny
Trzustka może reagować zbyt silnie na poposiłkowy wzrost glukozy, produkując nadmierną ilość insuliny. Skutkiem jest szybkie „wyczyszczenie” krwi z glukozy i wtórny spadek jej stężenia. Mechanizm ten może być związany m.in. z:
- hiperinsulinemią (produkcją nadmiernej ilości insuliny),
- zaburzeniami regulacji hormonalnej (np. z udziałem inkretyn – hormonów jelitowych uwalnianych po posiłku, które nasilają wydzielanie insuliny – takich jak GLP-1).
Najczęściej takie nadmierne działanie insuliny ma charakter przejściowy i nie jest związane z trwałą chorobą trzustki. Organizm po prostu reaguje zbyt intensywnie na pewne bodźce (np. posiłek), co skutkuje szybszym spadkiem glukozy. W medycynie opisuje się to jako zaburzenie czynnościowe, czyli wynikające raczej z nieprawidłowej regulacji hormonalnej niż ze zmian strukturalnych w narządach.
Rzadziej niedocukrzenia są skutkiem przyczyn organiczych czyli będących efektem konkretnej choroby. Przykładem jest insulinoma – łagodny nowotwór trzustki wydzielający insulinę niezależnie od poziomu cukru. Zwykle wywołuje niedocukrzenia na czczo, ale u niektórych osób może także nasilać spadki po posiłkach. Jeśli epizody są ciężkie (np. utrata przytomności, drgawki), pojawiają się w nocy lub na czczo, albo nawracają mimo zmian w diecie — skontaktuj się z lekarzem; potrzebna jest pogłębiona diagnostyka.
Insulinooporność i wczesna faza cukrzycy typu 2
W stanie przedcukrzycowym czy przy nieprawidłowej tolerancji glukozy (IGT, ang. Impaired Glucose Tolerance) dochodzi do zaburzeń fizjologicznego mechanizmu wydzielania insuliny. Osłabiona lub zniesiona jest pierwsza faza wydzielania insuliny, a druga faza pojawia się później i trwa zbyt długo. Skutkuje to początkową hiperglikemią poposiłkową, po której organizm produkuje nadmierne ilości insuliny (hiperinsulinemię).
Epizody te pojawiają się zazwyczaj 3–5 godzin po posiłku, kiedy działanie insuliny jest nadal aktywne, mimo że poziom glukozy we krwi zdążył już opaść. To właśnie wtedy u wielu osób występują charakterystyczne objawy hipoglikemii reaktywnej.
Zaburzenia motoryki przewodu pokarmowego
Tzw. dumping syndrome, czyli zbyt szybkie opróżnianie żołądka, to częsta przyczyna hipoglikemii reaktywnej u osób po operacjach bariatrycznych, pyloroplastyce, resekcji żołądka lub przełyku, wagotomii czy gastrektomii. Może też dotyczyć pacjentów z wrzodami żołądka i zaburzeniami perystaltyki. Gdy treść pokarmowa zbyt szybko trafia do jelita cienkiego, poziom glukozy gwałtownie rośnie, a następnie trzustka wydziela duże ilości insuliny – co kończy się szybkim spadkiem cukru.
GLP-1 a ryzyko hipoglikemii reaktywnej
GLP-1 (Glucagon-Like Peptide-1) to jelitowy hormon inkretynowy, uwalniany po posiłku. Reguluje gospodarkę węglowodanową: zwiększa zależne od stężenia glukozy wydzielanie insuliny, hamuje wydzielanie glukagonu, spowalnia opróżnianie żołądka i nasila uczucie sytości. Choć jego działanie jest fizjologicznie korzystne, u osób z tendencją do hipoglikemii reaktywnej może sprzyjać nadmiernej (często też opóźnionej) stymulacji trzustki i zbyt silnemu wyrzutowi insuliny, co w konsekwencji może prowadzić do nagłego spadku poziomu glukozy.
Zwiększona wrażliwość tkanek na działanie insuliny
Paradoksalnie nawet wysoka insulinowrażliwość – zazwyczaj uznawana za cechę pozytywną – może u niektórych osób sprzyjać hipoglikemii reaktywnej. W takich przypadkach nawet prawidłowe ilości insuliny powodują zbyt szybkie wchłanianie glukozy przez komórki i gwałtowny spadek jej poziomu we krwi.
Glukozuria nerkowa a hipoglikemia reaktywna
Glukozuria nerkowa to stan, w którym nerki wydalają zbyt dużo glukozy z moczem. Najczęściej obserwuje się ją u osób z cukrzycą, gdy poziom glukozy we krwi przekracza tzw. próg nerkowy. Istnieje jednak także glukozuria normoglikemiczna – sytuacja, gdy cukier wydalany jest mimo prawidłowego stężenia glukozy we krwi.
Może być ona związana z:
- uszkodzeniem kanalików nerkowych,
- stosowaniem niektórych leków (np. inhibitorów SGLT2),
- rzadkimi, wrodzonymi zaburzeniami metabolicznymi.
Nadmierna utrata glukozy przez nerki może prowadzić do niedoborów energetycznych i wtórnie powodować objawy hipoglikemii reaktywnej – takie jak osłabienie, drżenie rąk czy uczucie silnego głodu.
Helicobacter pylori a ryzyko hipoglikemii reaktywnej
Helicobacter pylori to bakteria, która zasiedla błonę śluzową żołądka. Jej obecność kojarzona jest głównie z wrzodami i zapaleniem żołądka, ale coraz więcej badań wskazuje, że może również wpływać na regulację poziomu cukru we krwi.
Nadmierna kolonizacja H. pylori może zaburzać:
- wydzielanie hormonów żołądkowo-jelitowych,
- gospodarkę glukozy i insuliny,
- reakcje organizmu po posiłkach.
Choć dokładny mechanizm nie jest jeszcze w pełni poznany, u części osób z infekcją obserwuje się większą podatność na spadki poziomu glukozy we krwi, zwłaszcza po posiłkach. Dlatego w diagnostyce hipoglikemii reaktywnej coraz częściej zwraca się uwagę także na obecność tej bakterii.
Czynniki ryzyka hipoglikemii reaktywnej
Choć hipoglikemia reaktywna może wystąpić także u osób pozornie zdrowych, istnieją pewne sytuacje i nawyki, które wyraźnie zwiększają ryzyko wystąpienia objawów. W medycynie nazywamy je czynnikami ryzyka – czyli elementami stylu życia lub cechami organizmu, które sprzyjają rozwojowi danej dolegliwości.
Wiek i masa ciała
Epizody częściej obserwuje się u młodych dorosłych (20–40 lat), zwykle z prawidłową masą ciała lub niewielką nadwagą. Ciekawostką jest to, że większe ryzyko mają również osoby, które ostatnio sporo schudły – prawdopodobnie dlatego, że ich tkanki stają się bardziej wrażliwe na insulinę.
Stres i obciążenie psychiczne
Przewlekły stres, napięcie emocjonalne, stany lękowe czy zwykłe przemęczenie mogą nasilać objawy hipoglikemii. Dzieje się tak dlatego, że hormony stresu – adrenalina i kortyzol – zaburzają naturalną równowagę glukozową organizmu. W praktyce oznacza to, że objawy mogą się nasilać nawet wtedy, gdy spadek poziomu cukru nie jest bardzo duży.
Nawyki żywieniowe
Styl jedzenia ma ogromne znaczenie dla stabilności poziomu cukru we krwi. Nieprawidłowe przyzwyczajenia mogą sprzyjać gwałtownym wahaniom glukozy i stanowić jeden z czynników ryzyka hipoglikemii reaktywnej. Ich konsekwencją bywa m.in. zmęczenie czy senność poposiłkowa.
Najczęstsze błędy to:
- zbyt długie przerwy między posiłkami (ponad 5–6 godzin),
- pomijanie śniadań,
- późne, obfite kolacje,
- dieta obfitująca w cukry proste (słodycze, białe pieczywo, słodzone napoje),
- niedobór błonnika, białka i zdrowych tłuszczów.
Takie schematy żywienia sprzyjają gwałtownym skokom i spadkom glukozy we krwi, a tym samym – epizodom hipoglikemii reaktywnej.
Zdjęcie 4. Czynniki ryzyka hipoglikemii reaktywnej. Stres w pracy i sięganie po słodycze sprzyjają gwałtownym wahaniom poziomu cukru we krwi, co może prowadzić do rozwoju objawów hipoglikemii reaktywnej.
Idiopatyczna hipoglikemia reaktywna – na czym polega?
Idiopatyczna hipoglikemia reaktywna (IRH, ang. Idiopathic Reactive Hypoglycaemia) to szczególny typ hipoglikemii poposiłkowej, który występuje u osób bez cukrzycy, insulinooporności czy wcześniejszych operacji żołądka. Mimo braku oczywistych czynników ryzyka, pacjenci doświadczają rzeczywistych epizodów niedocukrzenia – zwykle 1,5–4 godziny po posiłku. Często poziom glukozy spada wtedy nawet poniżej 2,5 mmol/l (45 mg/dl).
Badania wskazują, że u osób z IRH kluczową rolę odgrywa nadmierna wrażliwość tkanek na insulinę. Organizm nie produkuje większych ilości tego hormonu – jego poziom jest w normie – ale komórki reagują na insulinę wyjątkowo silnie. Efekt? Glukoza z krwi zostaje wychwycona zbyt szybko, co powoduje gwałtowny spadek jej stężenia.
Zaburzona odpowiedź przeciwhipoglikemiczna – co to oznacza?
Zwykle w sytuacji spadku glukozy organizm broni się, wydzielając glukagon – hormon, który podnosi poziom cukru we krwi. U osób z Idiopatyczną Hipoglikemią Reaktywną (IRH) ta odpowiedź bywa jednak osłabiona lub spóźniona, przez co organizm nie zdąży szybko wyrównać niedocukrzenia. Dodatkowo obserwuje się u nich wzrost poziomu kortyzolu, który również działa przeciwhipoglikemicznie, ale jego efekt pojawia się z opóźnieniem. Oznacza to, że pacjenci nie są chronieni przed nagłymi objawami, takimi jak senność, drżenie czy osłabienie.
Hipoglikemia reaktywna – współdziałanie wielu mechanizmów
Hipoglikemia reaktywna nie ma jednej przyczyny. Może wynikać z czynnościowych zaburzeń regulacji, ale czasem stoi za nią konkretna choroba (przyczyna organiczna). Najczęściej jednak problem rozwija się w wyniku współdziałania wielu mechanizmów – od nadmiernej reakcji trzustki, przez insulinooporność, aż po zaburzenia pracy przewodu pokarmowego. Zrozumienie, co dokładnie odpowiada za występowanie hipoglikemii reaktywnej u danej osoby, jest kluczem do trafnej diagnozy i dobrania właściwego postępowania.
5. Jak zdiagnozować hipoglikemię reaktywną?
Hipoglikemia poposiłkowa stanowi istotne wyzwanie diagnostyczne. Ze względu na niespecyficzne objawy (→ zob. Rozdział 2: Jakie są objawy hipoglikemii reaktywnej?), dużą zmienność indywidualną i brak jednoznacznych, standaryzowanych kryteriów, przypadłość ta bywa niedodiagnozowana, bagatelizowana, a czasem mylnie przypisywana problemom psychologicznym lub „nerwowości”.
Aby móc potwierdzić rozpoznanie, muszą być jednocześnie spełnione trzy podstawowe warunki znane jako triada Whipple’a:
- Wystąpienie objawów hipoglikemii (adrenergicznych lub neuroglikopenicznych),
- Udokumentowany spadek poziomu glukozy we krwi (poniżej 70 mg/dl),
- Ustąpienie objawów po spożyciu węglowodanów (np. w formie przekąski lub napoju zawierającego cukier).
Bez jednoczesnego spełnienia tych trzech elementów, rozpoznanie hipoglikemii reaktywnej jest niepełne i może prowadzić do błędnych wniosków diagnostycznych.
Na czym polega diagnostyka hipoglikemii reaktywnej?
Diagnostyka hipoglikemii reaktywnej opiera się na zestawieniu charakterystycznych objawów z wynikami badań laboratoryjnych i obserwacją reakcji organizmu po posiłkach. Ponieważ objawy niskiego cukru mogą mieć wiele przyczyn – od błędów dietetycznych, przez stres, aż po zaburzenia endokrynologiczne – rozpoznanie wymaga staranności i spojrzenia całościowego.
Nie istnieje jedno „złote badanie”, które jednoznacznie potwierdziłoby hipoglikemię reaktywną. W praktyce stosuje się kombinację metod, które wzajemnie się uzupełniają – od klasycznych testów obciążenia glukozą, przez testy posiłkowe, aż po nowoczesne systemy ciągłego monitorowania glikemii (CGM).
Punktem wyjścia powinien być dobrze zebrany wywiad, który pozwala zrozumieć tło objawów i określić, czy faktycznie mogą być one związane z nagłymi spadkami glukozy. Następnie – w zależności od sytuacji klinicznej – lekarz lub dietetyk może zalecić wykonanie odpowiednich testów, które potwierdzą lub wykluczą hipoglikemię poposiłkową.
Wywiad zdrowotno-żywieniowy
Diagnostyka hipoglikemii reaktywnej rozpoczyna się od dobrze przeprowadzonego wywiadu zdrowotno-żywieniowego. To podstawowe, ale niezwykle istotne narzędzie, które pozwala zidentyfikować czynniki mogące wpływać na pojawianie się objawów niedocukrzenia po posiłkach.
W trakcie takiego wywiadu analizuje się m.in.:
- styl życia – w tym pracę zmianową, poziom aktywności fizycznej, jakość snu i codzienny rytm dnia,
- nawyki żywieniowe – częstotliwość spożywania posiłków, obecność długich przerw między nimi, pomijanie śniadań, a także skład posiłków (zwłaszcza udział cukrów prostych),
- charakterystykę objawów – ich nasilenie, częstotliwość oraz moment występowania w odniesieniu do posiłków,
- stosowane leki, suplementy i używki, które mogą wpływać na metabolizm glukozy (np. alkohol, nikotyna)
- choroby współistniejące i przebyte zabiegi chirurgiczne, zwłaszcza w obrębie przewodu pokarmowego.
Zebrane informacje pozwalają określić, czy objawy mogą być powiązane z zaburzoną reakcją organizmu na spożycie węglowodanów, czy też wskazują na inne możliwe przyczyny.
Test obciążenia glukozą (OGTT)
Jednym z najczęściej stosowanych badań w diagnostyce hipoglikemii reaktywnej jest doustny test tolerancji glukozy (OGTT – Oral Glucose Tolerance Test). Polega on na podaniu pacjentowi 75 gramów czystej glukozy i monitorowaniu stężenia glukozy we krwi w kolejnych godzinach. Zwykle pomiary wykonuje się co 30–60 minut przez okres od 2 do nawet 5 godzin.
Test ten umożliwia ocenę, czy po gwałtownym wzroście glikemii (typowym po spożyciu czystej glukozy) dochodzi do jej nieprawidłowo szybkiego spadku. Choć metoda ta bywa pomocna, ma istotne ograniczenia.
W codziennym życiu rzadko spożywa się czystą glukozę – reakcja organizmu na taki bodziec może być więc sztuczna i nie do końca odzwierciedlać rzeczywiste warunki metaboliczne. U niektórych osób test ten może dawać wyniki, które sugerują problem, mimo że w praktyce go nie ma (tzw. wyniki fałszywie dodatnie), zwłaszcza jeśli mają one wysoką wrażliwość na insulinę. Dlatego OGTT nie powinien być jedynym kryterium w rozpoznawaniu hipoglikemii reaktywnej.
Zdjęcie 5. Test obciążenia glukozą (ORTT)
Dokładnie odmierzone 75 g glukozy rozpuszczone w letniej wodzie,które pacjent wypija w czasie nie dłuższym niż 5 minut i pobrania krwi, często w 0’/30’/60’/90’/120’/180’/240′ – tak wygląda praktyka OGTT, pomocna w rozpoznaniu hipoglikemii reaktywnej i innych zaburzeń glikemii.
Test posiłkowy (MMTT)
Coraz częściej jako alternatywę lub uzupełnienie OGTT stosuje się tzw. test posiłkowy, czyli Mixed Meal Tolerance Test (MMTT). W odróżnieniu od testu z czystą glukozą, polega on na podaniu pacjentowi zbilansowanego posiłku o określonej kompozycji makroskładników – zazwyczaj zawierającego około 20% białka, 30% tłuszczu i 50–60% węglowodanów.
Po spożyciu takiego posiłku monitoruje się poziom glukozy (oraz często również insuliny) przez kilka godzin. MMTT lepiej odzwierciedla realne warunki metaboliczne i pozwala ocenić, jak organizm reaguje na typowy, codzienny posiłek. Jest to szczególnie przydatne w diagnostyce hipoglikemii o niejasnym podłożu (idiopatycznej), gdzie spadek glikemii może pojawiać się nawet mimo prawidłowego poziomu insuliny.
Test posiłkowy jest uważany za bardziej fizjologiczny i trafniejszy diagnostycznie niż OGTT w przypadkach, gdy podejrzewa się hipoglikemię poposiłkową, a objawy nie są jednoznaczne.
Dzienniczek objawów i poziomu glukozy
Praktycznym narzędziem, które może wspierać zarówno diagnostykę, jak i późniejsze prowadzenie dietoterapii, jest dzienniczek obserwacji objawów i poziomu glukozy. Jego prowadzenie polega na systematycznym zapisywaniu:
- godzin i składu posiłków,
- momentów występowania objawów (takich jak senność po posiłku, głód, osłabienie, rozdrażnienie),
- wyników pomiarów glukozy wykonanych glukometrem – np. na czczo, 1–3 godziny po posiłku,
- ewentualnych dodatkowych czynników (np. intensywny wysiłek fizyczny, stres, brak snu).
Dzięki takiemu dzienniczkowi możliwe jest uchwycenie indywidualnych wzorców reakcji organizmu, a także bardziej precyzyjne dostosowanie zaleceń dietetycznych i dalszych kroków diagnostycznych.
Monitorowanie glikemii (CGM)
Systemy CGM (ang. Continuous Glucose Monitoring) umożliwiają ciągły pomiar stężenia glukozy w płynie otaczającym komórki (tzw. płynie śródmiąższowym) co kilka minut – przez całą dobę, przez kilka do kilkunastu dni. Urządzenie rejestruje dane automatycznie i prezentuje je w postaci wykresów, co pozwala analizować:
- reakcję organizmu na różne rodzaje posiłków,
- tempo spadku i wzrostu glikemii,
- ewentualne epizody hipoglikemii nocnej,
- korelację objawów z rzeczywistymi spadkami poziomu glukozy.
W przypadkach, gdy test obciążenia glukozą (OGTT) lub test posiłkowy (MMTT) nie wykazują wyraźnych nieprawidłowości, a pacjent nadal zgłasza typowe dolegliwości, CGM może dostarczyć kluczowych informacji i pomóc w potwierdzeniu rozpoznania.
6. Hipoglikemia reaktywna a inne choroby
Hipoglikemia reaktywna nie zawsze pojawia się jako samodzielne zaburzenie. U części osób występuje idiopatycznie, czyli bez uchwytnych przyczyn i towarzyszących problemów zdrowotnych. U innych jest powiązana z zaburzeniami metabolicznymi – takimi jak insulinooporność czy cukrzyca typu 2. Niedocukrzenia poposiłkowe mogą także współwystępować w przebiegu innych chorób, dlatego zawsze warto rozpatrywać występowanie hipoglikemii reaktywnej w kontekście innych jednostek chorobowych. O przyczynach hipoglikemii reaktywnej przeczytasz w Rozdziale 4: Przyczyny hipoglikemii reaktywnej
Czy hipoglikemia reaktywna to to samo co insulinooporność?
Hipoglikemia reaktywna i insulinooporność to dwa odrębne zaburzenia metaboliczne, choć mogą się ze sobą łączyć.
Insulinooporność polega na tym, że tkanki organizmu – przede wszystkim mięśnie, wątroba i tkanka tłuszczowa – reagują słabiej na działanie insuliny. Aby utrzymać prawidłowy poziom glukozy we krwi, trzustka musi wydzielać większe ilości tego hormonu. Prowadzi to do przewlekłej hiperinsulinemii, a z czasem do przeciążenia komórek β trzustki i zwiększonego ryzyka rozwoju cukrzycy typu 2.
Hipoglikemia reaktywna ma inne podłoże. Objawia się spadkiem poziomu glukozy kilka godzin po posiłku i wynika z zaburzonego dwufazowego wydzielania insuliny. W warunkach prawidłowych pierwsza faza polega na szybkim wyrzucie insuliny tuż po posiłku, a druga – na wolniejszej i dłuższej sekrecji hormonu. U osób z hipoglikemią reaktywną pierwsza faza jest osłabiona lub opóźniona, co powoduje gwałtowny wzrost glukozy, a następnie nadmierne i przedłużone wydzielanie insuliny w drugiej fazie. Efektem jest poposiłkowy spadek cukru poniżej normy.
W insulinooporności głównym problemem jest więc osłabiona wrażliwość tkanek na insulinę, natomiast w hipoglikemii reaktywnej – nieprawidłowy przebieg jej poposiłkowego wydzielania. U części osób oba mechanizmy mogą jednak współistnieć, co stanowi większe obciążenie dla organizmu i może być wczesnym sygnałem ryzyka rozwoju zaburzeń gospodarki węglowodanowej.
Cukrzyca typu 2 a hipoglikemia reaktywna
Cukrzyca typu 2 to choroba metaboliczna, w której organizm stopniowo traci zdolność do wykorzystania insuliny – hormonu odpowiedzialnego za utrzymanie prawidłowego poziomu glukozy we krwi. We wczesnym etapie choroby tkanki stają się mniej wrażliwe na jej działanie, a trzustka, aby utrzymać prawidłową glikemię, zwiększa produkcję tego hormonu. Za jego wytwarzanie odpowiadają komórki β trzustki, których zdolność do wydzielania insuliny z biegiem czasu stopniowo się obniża, co prowadzi do zaburzeń regulacji stężenia glukozy we krwi.
O rozwijających się zaburzeniach gospodarki węglowodanowej mogą świadczyć tzw. stany przedcukrzycowe (ang. prediabetes) obejmujące: podwyższony poziom glukozy na czczo lub nieprawidłową tolerancją glukozy w teście obciążenia glukozą (OGTT, ang. Oral Glucose Tolerance Test). Na tym etapie poposiłkowy wzrost poziomu glukozy we krwi jest szybszy i wyższy niż u osób zdrowych, ponieważ pierwsza faza wydzielania insuliny jest zaburzona. Prowadzi to do opóźnionej reakcji trzustki i nadmiernego wydzielania insuliny. W efekcie stężenie glukozy gwałtownie spada 3–5 godzin po posiłku. Zjawisko to określane jest jako hipoglikemia reaktywna w stanie przedcukrzycowym. Właśnie wtedy mogą pojawiać się objawy charakterystyczne dla niedocukrzenia, takie jak osłabienie, drżenie rąk, kołatanie serca czy wzmożony apetyt. Co istotne wspomniane objawy występują częściej u osób z nadwagą lub otyłością oraz u tych, u których w rodzinie rozpoznawano cukrzycę typu 2.
Czy hipoglikemia reaktywna może występować bez cukrzycy?
Tak – hipoglikemia reaktywna bez cukrzycy jest możliwa. U części osób epizody niedocukrzeń pojawiają się mimo braku cukrzycy czy stanu przedcukrzycowego. Najczęściej rozpoznaje się wtedy tzw. idiopatyczną hipoglikemię reaktywną. Objawy występują zwykle w ciągu 2–3 godzin po posiłku, a dokładny mechanizm tego zjawiska nie jest w pełni poznany.
Naukowcy wskazują jednak kilka możliwych przyczyn:
- nadmierna aktywność hormonu GLP-1 – odpowiada on za pobudzanie wydzielania insuliny po jedzeniu; u niektórych osób działa zbyt silnie,
- zaburzona odpowiedź glukagonu – ten hormon zwykle chroni przed spadkiem cukru, ale jego reakcja bywa osłabiona lub spóźniona,
- zwiększona wrażliwość tkanek na insulinę – nawet normalne ilości insuliny powodują wtedy szybki spadek poziomu glukozy,
- nieprawidłowa regulacja nerwowo-hormonalna – układ nerwowy i hormony nie zawsze działają w idealnej równowadze,
- czynniki środowiskowe, np. zakażenie bakterią Helicobacter pylori, które może wpływać na metabolizm glukozy.
Zdjęcie 6. Samokontrola glikemii.
Glukometr to narzędzie samokontroli, które pomaga notować spadki glukozy <70 mg/dl (zwykle 2–5 h po posiłku) w przebiegu hipoglikemii reaktywnej oraz kontrolować glikemię w insulinooporności, stanie przedcukrzycowym (prediabetes) i cukrzycy typu 2. Choć to różne zaburzenia, łączy je nieprawidłowa regulacja insuliny i glukozy. Wyniki omawiaj ze specjalistą – lekarzem i dietetykiem klinicznym.
7. Leczenie i styl życia w hipoglikemii reaktywnej
Jak radzić sobie z hipoglikemią reaktywną na co dzień?
Jednym z najważniejszych elementów w codziennym funkcjonowaniu z hipoglikemią reaktywną jest świadomość zaburzenia i zrozumienie mechanizmów, które za nim stoją. Dobrze postawiona diagnoza to pierwszy krok — nie tylko medyczny, ale także psychologiczny. Dla wielu osób uświadomienie sobie, że powtarzające się objawy mają realną, fizjologiczną przyczynę, przynosi ulgę i poczucie, że można nad nimi zapanować.
Codzienne funkcjonowanie z hipoglikemią reaktywną wymaga przede wszystkim działań profilaktycznych, które pozwalają utrzymać stabilny poziom glukozy we krwi i zapobiegać epizodom niedocukrzenia. Kluczowe jest:
- zidentyfikowanie czynników wywołujących hipoglikemię,
- eliminacja lub ograniczenie sytuacji nasilających spadki glikemii,
- umiejętność szybkiego reagowania w przypadku pojawienia się objawów,
- monitorowanie reakcji organizmu na jedzenie, stres, sen i wysiłek fizyczny,
- rozwijanie samoświadomości i uważności na sygnały ciała, także te subtelne, które mogą świadczyć o zbliżającym się niedocukrzeniu (np. nagła zmiana nastroju, osłabienie koncentracji, senność czy rozdrażnienie).
Dla wielu osób początki bywają trudne – wymagają większej uważność i gotowości do wprowadzenia zmian. Jednak z czasem pacjenci uczą się rozpoznawać pierwsze, często bardzo dyskretne objawy hipoglikemii i lepiej rozumieją, jak ich organizm reaguje w różnych sytuacjach. Taka samoobserwacja to klucz do odzyskania kontroli nad własnym samopoczuciem i zapobiegania nawrotom dolegliwości.
Hipoglikemia reaktywna nie musi oznaczać życia pod znakiem ograniczeń. Dzięki odpowiedniemu podejściu i edukacji można osiągnąć stabilność glikemii, zyskać większą kontrolę nad swoim zdrowiem i codziennym funkcjonowaniem. Choć nie dzieje się to od razu, regularna praca i uważność na potrzeby organizmu mogą przynieść realną poprawę jakości życia.
Jakie są metody leczenia hipoglikemii reaktywnej?
Leczenie hipoglikemii reaktywnej opiera się głównie na działaniach niefarmakologicznych, czyli zmianie stylu życia i dietoterapii. W niektórych przypadkach, gdy objawy nie ustępują mimo stosowania odpowiedniej diety lub gdy hipoglikemia współistnieje z innymi problemami metabolicznymi (np. insulinoopornością), lekarz może rozważyć leczenie farmakologiczne. Celem jest utrzymanie stabilnego poziomu cukru i ograniczenie epizodów, które obniżają jakość życia.
Rola dietoterapii w leczeniu hipoglikemii reaktywnej
Podstawą leczenia hipoglikemii reaktywnej jest modyfikacja diety. Odpowiednio zaplanowany sposób żywienia pomaga ograniczyć gwałtowne zmiany poziomu glukozy i zmniejszyć ryzyko wystąpienia objawów. Kluczowe elementy dietoterapii to:
- Regularność posiłków – ważne jest ustalenie odpowiedniej liczby posiłków w ciągu dnia oraz kontrola przerw między nimi, tak aby uniknąć zarówno nadmiernego głodu, jak i przejadania się.
- Jakość i skład posiłków – warto wybierać produkty, które wspierają stopniowy wzrost poziomu glukozy we krwi (np. warzywa, produkty pełnoziarniste, rośliny strączkowe), i unikać tych, które powodują jego szybki wzrost, jak słodycze, białe pieczywo czy napoje słodzone.
- Ilość i proporcje makroskładników – każdy posiłek powinien zawierać odpowiednie proporcje węglowodanów, białka i tłuszczów. Szczególną uwagę warto zwrócić na ilość spożywanych węglowodanów.
- Sposób przygotowania posiłków – stopień rozdrobnienia i rozgotowania wpływają na tempo trawienia i wchłaniania glukozy. Produkty silnie rozgotowane lub rozdrobnione mogą powodować szybszy wzrost glikemii po posiłku.
- Redukcja masy ciała (jeśli występuje nadwaga lub otyłość) – szczególnie przy współwystępującej insulinooporności – może znacząco poprawić wrażliwość tkanek na insulinę. Efektem jest bardziej stabilna glikemia poposiłkowa i ograniczenie nadmiernych wyrzutów insuliny, które mogą prowadzić do epizodów hipoglikemii.
Postępowanie dietetyczne w sytuacjach niedocukrzenia
W przypadku spadku glukozy ważne jest szybkie działanie. Stosuje się tzw. zasadę 15–15: spożycie 15 g szybko przyswajalnych węglowodanów (np. pół banana, ½ szklanki soku, łyżka miodu), odczekanie 15 minut i ponowny pomiar glukozy. Jeśli nadal jest <70 mg/dl – dawkę powtarza się.
W hipoglikemii reaktywnej należy jednak zachować ostrożność. Zbyt duża ilość cukru może spowodować efekt odbicia: nagły wzrost glukozy, wyrzut insuliny i kolejny spadek. Dlatego po ustabilizowaniu glikemii warto zjeść niewielki, mieszany posiłek z węglowodanami złożonymi, białkiem i tłuszczami – np. kromkę chleba pełnoziarnistego z dodatkiem białka i zdrowych tłuszczów.
Wsparcie psychologiczne
Hipoglikemia reaktywna to nie tylko kwestia fizjologii, ale także emocji. Stres, lęk czy obniżony nastrój mogą nasilać objawy i utrudniać stosowanie diety. W niektórych przypadkach pomocne jest wsparcie psychologa lub psychoterapeuty – nauka radzenia sobie z napięciem, techniki relaksacyjne i edukacja emocjonalna poprawiają komfort życia i wspierają skuteczność leczenia.
Styl życia jako element leczenia hipoglikemii reaktywnej
Oprócz diety duże znaczenie ma styl życia: odpowiednia ilość snu, unikanie przewlekłego stresu, regularna aktywność fizyczna i stabilny rytm dnia. Ćwiczenia zwiększają wrażliwość tkanek na insulinę, wspierają kontrolę poziomu cukru i pomagają utrzymać prawidłową masę ciała. Ważne, aby unikać intensywnego wysiłku na czczo i tuż po posiłkach o wysokim indeksie glikemicznym. Najlepiej sprawdzają się ćwiczenia o umiarkowanej intensywności, poprzedzone lekkim, zbilansowanym posiłkiem.
Farmakoterapia w hipoglikemii reaktywnej
Leczenie farmakologiczne stosuje się rzadko, ale bywa konieczne, gdy zmiana diety i stylu życia nie wystarczają. Możliwe opcje to:
- Akarboza – inhibitor enzymów trawiących węglowodany (α–glukozydaz). Działa poprzez spowolnienie rozkładu i wchłaniania węglowodanów w jelicie cienkim, co ogranicza gwałtowny wzrost glukozy po posiłku. Dzięki temu zmniejsza się ryzyko nadmiernego wyrzutu insuliny i hipoglikemii poposiłkowej. Akarboza może być pomocna szczególnie u pacjentów z wczesną hipoglikemią poposiłkową, pojawiającą się 1-2 godziny po jedzeniu.
- Metformina – substancja stosowana głównie u osób z towarzyszącą insulinoopornością lub stanem przedcukrzycowym. Lek ten poprawia insulinowrażliwość tkanek, ogranicza wątrobową produkcję glukozy (glukoneogenezę) i zmniejsza tempo jej wchłaniania w jelitach. Dodatkowo stabilizuje poposiłkową glikemię, zmniejszając ryzyko hiperinsulinemii i następujących po niej spadków cukru.
- Analogi GLP-1 (np. dulaglutyd) – mogą być rozważane u pacjentów z hipoglikemią reaktywną, szczególnie po operacjach bariatrycznych lub innych zabiegach w obrębie górnego odcinka przewodu pokarmowego. Leki te spowalniają opróżnianie żołądka i tranzyt jelitowy, ograniczając gwałtowny wzrost glukozy po posiłku. Dodatkowo wspierają prawidłowe wydzielanie GLP-1 i pomagają kontrolować ilość insuliny uwalnianej w odpowiedzi na jedzenie. Dzięki temu zmniejszają ryzyko nadmiernego wyrzutu insuliny i późniejszego spadku poziomu glukozy.
- Diazoksyd – to lek obniżający wydzielanie insuliny przez komórki beta trzustki. Może być stosowany w wyjątkowych przypadkach, np. przy potwierdzonej hiperinsulinemii.
- Analogi somatostatyny (np. oktreotyd) – hamują wydzielanie insuliny, glukagonu oraz inkretyn (GLP-1). Stosowane głównie u pacjentów po zabiegach chirurgicznych na przewodzie pokarmowym (np. po operacjach bariatrycznych), u których dochodzi do nadmiernej odpowiedzi hormonalnej po posiłkach i trudnych do opanowania epizodów hipoglikemii.
Warto podkreślić, że farmakoterapia nie zastępuje zmiany stylu życia ani odpowiednio prowadzonej dietoterapii — to one pozostają podstawą leczenia hipoglikemii reaktywnej. Leki mogą być pomocnym uzupełnieniem terapii w trudniejszych przypadkach, ale ich stosowanie zawsze wymaga indywidualnej decyzji lekarskiej, poprzedzonej dokładną oceną stanu zdrowia pacjenta.
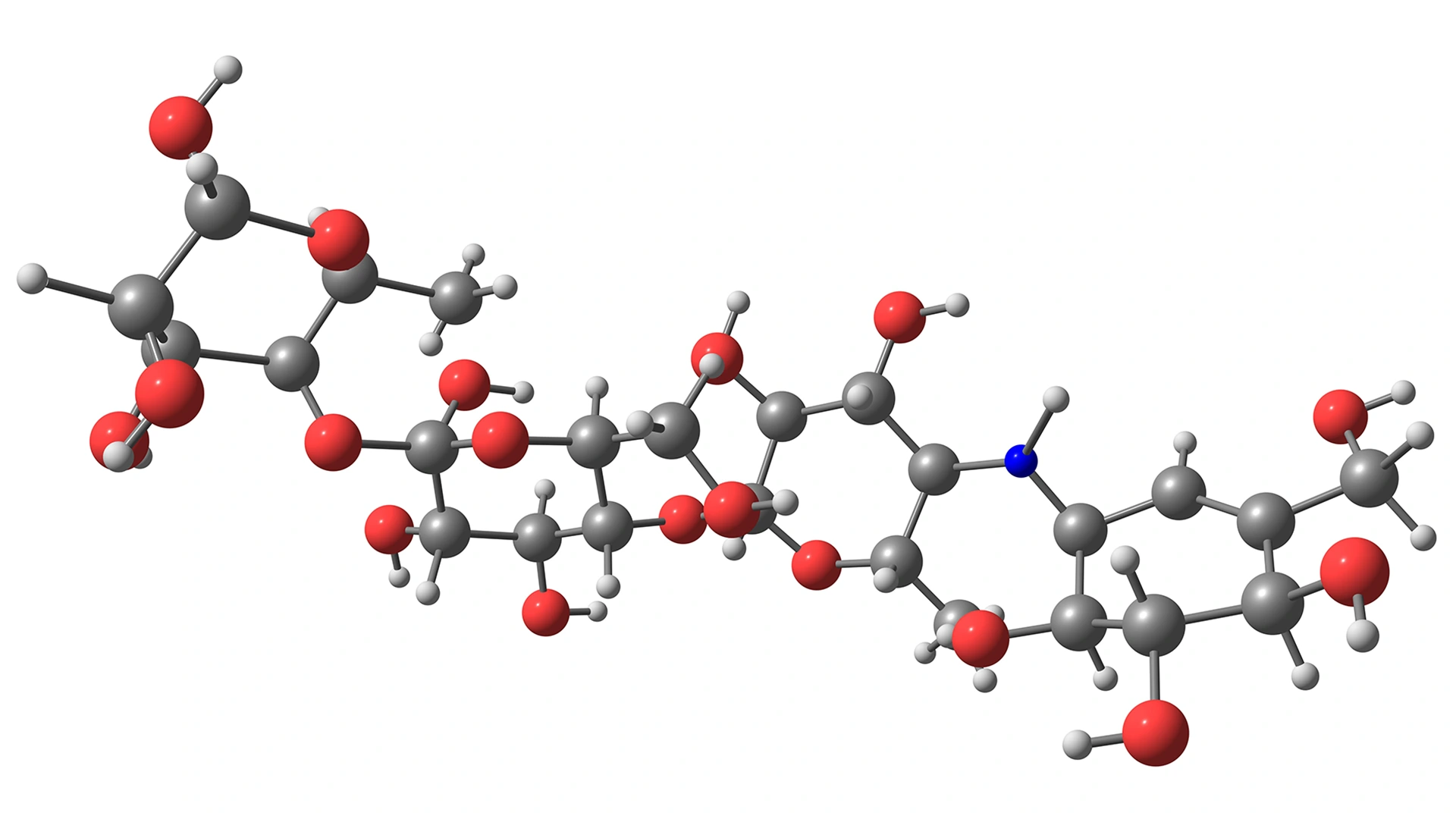
Rysunek 7. Cząsteczka akarbozy
Akarboza jest substancją czynną kilku leków na receptę wskazanych w leczeniu cukrzycy typu 2. Jej miejscem działania jest układ pokarmowy, gdzie hamuje enzymy trawiące cukry (tzw. α-glukozydazy), przez co spowalnia rozkład skrobi oraz dwucukrów takich jak sacharoza i maltoza. Skutkiem jest zależne od dawki opóźnienie trawienia węglowodanów, a więc mniejsze poposiłkowe wzrosty glikemii. Lek bywa też stosowany poza oficjalnym wskazaniem (off-label) u wybranych pacjentów z hipoglikemią reaktywną, gdy sama dieta nie wystarcza do kontroli objawów. W razie hipoglikemii u osób przyjmujących akarbozę skuteczna jest wyłącznie glukoza (dekstroza); produkty oparte na sacharozie zadziałają słabiej i wolniej.
Aktywność fizyczna a hipoglikemia reaktywna
Regularna aktywność fizyczna odgrywa istotną rolę w stabilizacji poziomu glukozy we krwi, zwłaszcza u osób z hipoglikemią reaktywną powiązaną z insulinoopornością. Ćwiczenia zwiększają wrażliwość tkanek na działanie insuliny, wspomagają lepszą kontrolę glikemii po posiłkach, a także pomagają w utrzymaniu prawidłowej masy ciała.
Podczas wysiłku mięśnie zużywają glukozę jako źródło energii, co zmniejsza jej stężenie we krwi w sposób naturalny. Aby uniknąć niedocukrzenia, warto ćwiczyć regularnie, ale unikać wysiłku na czczo i bezpośrednio po posiłkach o wysokim indeksie glikemicznym. Dobrze sprawdza się aktywność o umiarkowanej intensywności, poprzedzona lekkim, zbilansowanym posiłkiem zawierającym węglowodany złożone i źródło białka.
W przypadku osób intensywnie trenujących lub zawodowo uprawiających sport, zalecenia żywieniowe mogą wymagać dodatkowej modyfikacji — temu zagadnieniu poświęcony jest osobny Rozdział 11: Hipoglikemia reaktywna u sportowców.
8. Hipoglikemia reaktywna – zapobieganie
W przypadku hipoglikemii reaktywnej najważniejsze są działania zapobiegawcze, które pomagają unikać spadków poziomu glukozy, zanim pojawią się objawy. Zamiast reagować dopiero, gdy wystąpią zawroty głowy, drżenie rąk czy senność, znacznie korzystniejsze jest zadbanie o utrzymanie stabilnego poziomu cukru przez cały dzień.
Zapobieganie hipoglikemii reaktywnej często wymaga indywidualnego podejścia, ponieważ przyczyny tego zaburzenia są różne, mimo podobnych objawów. Dla jednej osoby kluczowa może być zmiana składu posiłków, dla innej – redukcja stresu, wsparcie psychodietetyczne lub poprawa wrażliwości insulinowej (np. dzięki redukcji masy ciała, aktywności fizycznej, diecie czy farmakoterapii).
W kolejnych punktach pokazujemy konkretne sposoby, które pomogą zmniejszyć ryzyko epizodów niedocukrzenia i ułatwią codzienne funkcjonowanie.
Jak zapobiegać niedocukrzeniu w codziennym życiu?
Codzienne nawyki żywieniowe oraz styl życia mają kluczowe znaczenie w zapobieganiu epizodom hipoglikemii reaktywnej. Zarówno regularność posiłków, ich skład, ilość jak i jakość spożywanych węglowodanów wpływają na tempo wchłaniania glukozy i odpowiedź hormonalną organizmu po jedzeniu.
U osób podatnych na hipoglikemię poposiłkową nieprawidłowe wybory żywieniowe – takie jak np. posiłki bazujące głównie na węglowodanach lub zbyt długie przerwy między posiłkami – mogą nasilać ryzyko epizodów hipoglikemii. Z kolei regularne, zbilansowane posiłki zawierające błonnik, białko i zdrowe tłuszcze spowalniają tempo trawienia i wchłaniania glukozy, pomagając utrzymać stabilny poziom cukru we krwi.
Dlatego odpowiedni sposób odżywiania to absolutna podstawa codziennego funkcjonowania osób z hipoglikemią reaktywną. Ważna jest jednak nie tylko jakość diety, ale też świadoma obserwacja reakcji organizmu – po jakich potrawach pojawiają się objawy, jaka długość przerwy między jedzeniem im sprzyja i czy pora dnia ma znaczenie.
Nie tylko dieta wpływa na ryzyko spadku glukozy. Styl życia czyli m.in. sen, stres i ogólne obciążenie psychiczne również mają istotne znaczenie. Badania pokazują, że:
- Niedobór snu zmniejsza tolerancję glukozy i zwiększa insulinooporność, co może nasilać wahania glikemii poposiłkowej.
- Przewlekły stres podnosi poziom kortyzolu i adrenaliny, które zaburzają reakcje hormonalne po jedzeniu i mogą nasilać objawy hipoglikemii.
- Obniżony nastrój i stany lękowe mogą obniżać próg odczuwania objawów hipoglikemii, sprawiając, że są one bardziej uciążliwe nawet przy niewielkich spadkach glukozy.
Dlatego dbałość o regularny sen, regenerację, redukcję stresu oraz ogólny dobrostan psychofizyczny stanowi ważny element profilaktyki.
Samoświadomość to kolejny kluczowy element zapobiegania hipoglikemii reaktywnej. Pomocne może być prowadzenie dzienniczka objawów i glikemii, w którym notuje się:
- skład i pory posiłków,
- odczuwane objawy i ich nasilenie,
- okoliczności towarzyszące (np. stres, aktywność fizyczna, brak snu).
W niektórych przypadkach warto rozważyć zastosowanie systemów ciągłego monitorowania glikemii (CGM – Continuous Glucose Monitoring), które umożliwiają bieżące śledzenie zmian poziomu cukru we krwi w ciągu doby, również podczas snu czy po różnych typach posiłków.
Choć CGM na co dzień wykorzystywany jest głównie w leczeniu cukrzycy, znajduje też zastosowanie u pacjentów z hipoglikemią reaktywną. Umożliwia wcześniejsze wychwycenie trendu spadku glikemii i zapobiega cięższym epizodom niedocukrzenia, dając czas na odpowiednią reakcję.
Warto jednak pamiętać, że korzystanie z CGM wymaga edukacji i zrozumienia danych, ponieważ zbyt impulsywne reagowanie na naturalne wahania glikemii (np. częste podjadanie przy niewielkim spadku) może paradoksalnie pogarszać kontrolę. Dlatego najlepiej wdrażać tę technologię pod opieką specjalisty np. diabetologa, dietetyka lub lekarza prowadzącego.
Indeks glikemiczny (IG) a objawy hipoglikemii reaktywnej
Istotnym czynnikiem wpływającym na występowanie objawów hipoglikemii reaktywnej jest indeks glikemiczny (IG) spożywanych produktów. To wskaźnik, który określa, jak szybko po spożyciu danego produktu zawierającego 50 g węglowodanów, wzrasta poziom glukozy we krwi w porównaniu do 50 g czystej glukozy, której IG przyjęto za wartość referencyjną równą 100.
Produkty spożywcze dzielimy na trzy grupy:
- niski IG (≤55) – powodują wolny i stopniowy wzrost glukozy
- średni IG (56–69)
- wysoki IG (≥70) – wywołują gwałtowny wzrost poziomu glukozy po posiłku
U osób z hipoglikemią reaktywną to właśnie gwałtowny wzrost poziomu glukozy po posiłku, a następnie silny wyrzut insuliny, mogą prowadzić do późniejszego spadku cukru we krwi i wystąpienia objawów niedocukrzenia, takich jak osłabienie, senność, drżenie rąk czy rozdrażnienie. Dieta oparta na produktach o niskim indeksie glikemicznym odgrywa ważną rolę w zapobieganiu tym objawom. Dzięki temu, że spowalnia wchłanianie glukozy do krwi, pomaga utrzymać stabilny poziom cukru po posiłku i zmniejsza ryzyko nadmiernego wyrzutu insuliny. W efekcie ogranicza gwałtowne spadki glikemii i łagodzi nieprzyjemne dolegliwości.
Warto jednak zaznaczyć, że indeks glikemiczny danego produktu może się różnić w zależności od wielu czynników – nie tylko od rodzaju żywności, ale także sposobu jej przygotowania oraz połączeń z innymi składnikami. Oto najważniejsze elementy, które mogą pomóc w obniżeniu indeksu glikemicznego posiłku lub ograniczeniu jego wpływu na poposiłkową glikemię:
- Obecność błonnika pokarmowego
Produkty bogate w błonnik – takie jak warzywa, pełnoziarniste zboża czy rośliny strączkowe – spowalniają trawienie i wchłanianie węglowodanów, co skutkuje wolniejszym wzrostem poziomu glukozy we krwi. - Dodatek białka i tłuszczu do posiłku
Obecność białka (np. jaj, jogurtu, mięsa) i tłuszczu (np. orzechów, awokado, oliwy) w posiłku wydłuża czas opróżniania żołądka i spowalnia wchłanianie glukozy, co przekłada się na niższy IG całego dania. - Stopień przetworzenia produktu
Im mniej rozdrobniony i mniej oczyszczony produkt, tym niższy jego indeks glikemiczny. Na przykład: kasza gryczana ma znacznie niższy IG niż kaszka błyskawiczna, a chleb pełnoziarnisty niż biały tostowy. - Chłodzenie produktów skrobiowych
Po ugotowaniu i schłodzeniu produktów bogatych w skrobię (np. ziemniaków, makaronu, ryżu), w ich strukturze tworzy się tzw. skrobia oporna, która nie jest trawiona w jelicie cienkim. To powoduje mniejszy wzrost glukozy we krwi po spożyciu takich produktów. - Kolejność spożywania składników w posiłku
Choć nie zmienia ona indeksu glikemicznego produktów, badania sugerują, że rozpoczęcie posiłku od warzyw lub białka (np. sałatki lub kawałka mięsa), a dopiero potem spożycie produktów bogatych w węglowodany, może znacząco poprawiać kontrolę glikemii poposiłkowej i zmniejszać wyrzuty insuliny.
Dlatego świadome wybory żywieniowe, oparte na znajomości indeksu glikemicznego i zasad komponowania posiłków, mogą znacząco zmniejszyć ryzyko epizodów hipoglikemii reaktywnej i poprawić codzienne samopoczucie.
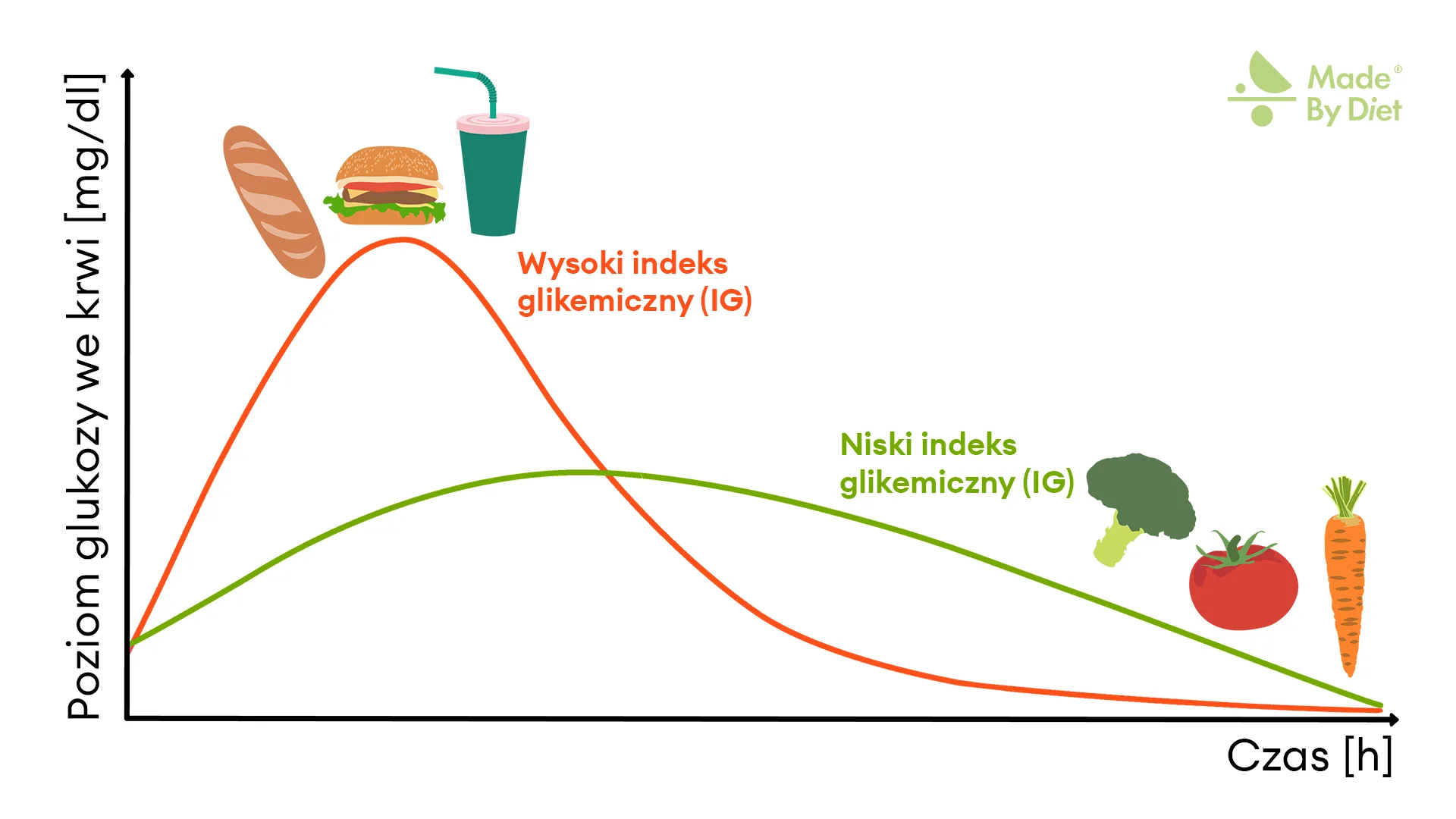
Rysunek 8. Indeks glikemiczny produktów a krzywa glukozy.
Produkty o wysokim IG (pieczywo, fast-food, słodki napój) powodują szybki, wysoki pik i gwałtowny spadek glikemii, podczas gdy niski IG (warzywa) daje łagodniejszy wzrost i stabilniejszy poziom cukru.
Jak dieta pomaga zapobiegać spadkom cukru?
Dla wielu osób z hipoglikemią reaktywną objawy takie jak rozdrażnienie, nagłe uczucie osłabienia, spadek koncentracji czy niepokój pojawiają się niespodziewanie i potrafią znacząco utrudnić codzienne funkcjonowanie. W takiej sytuacji dieta staje się nie tylko narzędziem terapeutycznym, ale również sposobem na odzyskanie kontroli nad swoim samopoczuciem.
Wiedza o tym, jak organizm reaguje na konkretne produkty i sposób ich spożywania, daje poczucie bezpieczeństwa – pozwala przewidywać reakcje organizmu, a nie jedynie na nie reagować. Świadome planowanie posiłków pomaga wyprzedzać momenty spadku glukozy, a nie tylko łagodzić ich skutki.
Zamiast żyć w obawie przed kolejnym epizodem, osoby z hipoglikemią reaktywną mogą poprzez odpowiednie wybory żywieniowe zyskać większy spokój, stabilność emocjonalną i lepszą jakość życia. Odpowiednia dieta to nie tylko kwestia „co jeść”, ale też jak i kiedy, by lepiej rozumieć własne ciało i wspierać jego naturalne mechanizmy regulacji.
9. Dieta w hipoglikemii reaktywnej
Czy dieta naprawdę może pomóc w zapobieganiu hipoglikemii reaktywnej? Zdecydowanie tak – sposób, w jaki jemy, to najważniejszy czynnik wpływający na stabilność poziomu glukozy we krwi po posiłkach. Właściwie dobrana dieta potrafi skutecznie ograniczyć objawy takie jak zmęczenie, senność, drżenie rąk, rozdrażnienie czy wilczy głód [→ zob. Rozdział 2. Jakie są objawy hipoglikemii reaktywnej?].
Choć hipoglikemia reaktywna nie została jeszcze szczegółowo opisana w oficjalnych zaleceniach publikowanych przez Polskie Towarzystwo Diabetologiczne, to wiele zaleceń dietetycznych stosowanych w zaburzeniach gospodarki węglowodanowej (np. insulinooporności czy cukrzycy) świetnie sprawdza się również tutaj.
Badania pokazują, że regularne posiłki o niskim indeksie glikemicznym, z odpowiednią zawartością błonnika i białka, mogą nie tylko łagodzić objawy hipoglikemii poposiłkowej, ale też zapobiegać ich nawrotom. To właśnie codzienne nawyki żywieniowe mają kluczowe znaczenie — dlatego warto poznać zasady, które naprawdę działają.
Hipoglikemia reaktywna – co jeść?
Aby skutecznie zapobiegać objawom hipoglikemii reaktywnej, dieta powinna wspierać utrzymanie stabilnego poziomu glukozy we krwi – bez nagłych wzrostów jej stężenia po posiłku i gwałtownych spadków kilka godzin później. Kluczowe znaczenie ma nie tylko dobór produktów, ale także regularność posiłków i sposób ich komponowania.
Hipoglikemia reaktywna a regularność posiłków – jak często jeść?
Dieta osób z hipoglikemią reaktywną powinna opierać się na regularnym spożywaniu posiłków, najlepiej co około 3 godziny, z zachowaniem umiarkowanej i podobnej zawartości węglowodanów. Korzystne jest spożywanie 4-5 mniejszych posiłków dziennie. Pozwala to na równomierne dostarczanie energii i zapobiega dużym wahaniom poziomu glukozy.
Śniadanie odgrywa tutaj szczególną rolę – pomijanie go może nasilać późniejsze poposiłkowe spadki cukru i zaburzać rytm glikemii w ciągu dnia. Również długie przerwy między posiłkami nie są wskazane – mogą prowadzić do nadmiernego głodu, sięgania po produkty o wysokim indeksie glikemicznym i w efekcie do nagłych skoków, a potem spadków glukozy.
Dlaczego to ważne? Zbyt rzadkie jedzenie może prowadzić do gwałtownych reakcji metabolicznych po posiłku — najpierw dochodzi do szybkiego wzrostu poziomu glukozy we krwi, a następnie do jej nagłego spadku w wyniku nasilonego wyrzutu insuliny. Utrzymywanie regularnych godzin jedzenia i zbilansowanych porcji pomaga stabilizować glikemię, zmniejsza ryzyko hipoglikemii i poprawia ogólne samopoczucie.
Kompozycja posiłków w hipoglikemii reaktywnej
W przypadku hipoglikemii reaktywnej liczy się nie tylko to ile jemy i kiedy, ale przede wszystkim jakie produkty wybieramy i jak je łączymy w jednym posiłku. Prawidłowo skomponowany posiłek powinien wspierać stabilizację glikemii, ograniczać gwałtowne wyrzuty insuliny i zapewniać długotrwałe uczucie sytości. Kluczowe znaczenie ma tu jakość węglowodanów, obecność białka, tłuszczów i błonnika, a także sposób przygotowania potraw.
-
Węglowodany o niskim indeksie i ładunku glikemicznym
W przypadku hipoglikemii reaktywnej ważna jest nie tylko jakość, ale też ilość spożywanych węglowodanów. Indeks glikemiczny (IG) określa, jak szybko po spożyciu danego produktu wzrasta poziom glukozy we krwi, natomiast ładunek glikemiczny (ŁG) uwzględnia zarówno tempo wchłaniania węglowodanów, jak i ich ilość w porcji produktu.
To właśnie ładunek glikemiczny w większym stopniu odzwierciedla rzeczywisty wpływ danego posiłku na glikemię. Produkty o wysokim IG, ale spożywane w małych ilościach, mogą mieć niski ŁG i odwrotnie. Przykładowo: arbuz ma wysoki indeks glikemiczny, ale zawiera niewiele węglowodanów w jednej porcji — dlatego jego ładunek glikemiczny jest niski. Z kolei duża porcja brązowego ryżu, mimo umiarkowanego IG, może mieć wysoki ŁG, co oznacza większe ryzyko gwałtownego wzrostu glukozy.
Dlatego w diecie przy hipoglikemii reaktywnej ważny jest nie tylko rodzaj węglowodanów, ale też ilość, jaką spożywamy w jednym posiłku. Połączenie niskiego IG i umiarkowanej porcji daje najlepszy efekt w stabilizowaniu glikemii.
Do produktów o niskim indeksie glikemicznym zaliczamy m.in.:
- warzywa nieskrobiowe (np. brokuły, cukinia, papryka)
- rośliny strączkowe (np. soczewica, ciecierzyca, fasola)
- produkty pełnoziarniste (np. chleb żytni razowy, makaron pełnoziarnisty ugotowany al dente, kasza gryczana, płatki owsiane zwykłe/górskie)
- niektóre owoce (np. jabłko, gruszka, jagody)
- orzechy i nasiona
Zdjęcie 9. Przykładowy posiłek o niskim indeksie glikemicznym.
Dla osób zmagających się z hipoglikemią reaktywną – grillowana pierś z kurczaka z zieloną fasolką, rukolą i pieczoną dynią to przykład zbilansowanego posiłku o niskim IG. I choć dynia sama w sobie ma wysoki IG, jej niewielka ilość i połączenie z białkiem oraz warzywami sprawiają, że całość ogranicza nagłe zmiany poziomu glukozy we krwi. To pokazuje, że w diecie przy hipoglikemii reaktywnej nie trzeba całkowicie eliminować pewnych produktów – kluczem jest właściwa kompozycja posiłków.
-
Błonnik pokarmowy
Odpowiednia ilość błonnika w posiłku odgrywa kluczową rolę w zapobieganiu nagłym spadkom poziomu glukozy we krwi. Błonnik rozpuszczalny, obecny m.in. w warzywach, owocach i roślinach strączkowych, tworzy w przewodzie pokarmowym żelową strukturę, która spowalnia opróżnianie żołądka oraz wydłuża czas wchłaniania glukozy do krwiobiegu. Dzięki temu zmniejsza poposiłkowe skoki glikemii i ryzyko wtórnej hipoglikemii.
Błonnik stymuluje także wydzielanie hormonów jelitowych takich jak GLP-1 i GIP, które poprawiają kontrolę glikemii oraz wpływają na szybsze pojawienie się uczucia sytości. Dodatkowo, wyższa zawartość błonnika w diecie może wspierać regulację masy ciała i poprawę wrażliwości tkanek na insulinę.
Dobrym źródłem błonnika są:
- warzywa (szczególnie nieskrobiowe, np. brokuły, jarmuż, cukinia)
- owoce o niskim IG (np. jabłka, gruszki, maliny)
- nasiona (np. siemię lniane, chia)
- orzechy
- produkty pełnoziarniste (np. chleb żytni razowy, płatki owsiane zwykłe/górskie, kasza gryczana)
- rośliny strączkowe (np. soczewica, fasola, ciecierzyca)
-
Białko w każdym posiłku
Obecność białka w posiłku ma istotne znaczenie dla kontroli glikemii. Spowalnia ono opróżnianie żołądka, co prowadzi do wolniejszego wchłaniania węglowodanów i bardziej łagodnego wzrostu poziomu glukozy po jedzeniu. Białko stymuluje także wydzielanie inkretyn, zwłaszcza GLP-1, które korzystnie wpływają na odpowiedź insulinową i pomagają utrzymać stabilną glikemię.
Niektóre aminokwasy mogą również pełnić funkcję substratów dla glukoneogenezy – procesu, w którym organizm wytwarza glukozę z innych źródeł, co może być pomocne w utrzymaniu jej odpowiedniego poziomu między posiłkami.
Dobrymi źródłami białka są: jajka; chude mięso (np. drób, cielęcina); ryby i owoce morza; tofu i tempeh; fermentowane produkty mleczne (np. jogurt naturalny, kefir); rośliny strączkowe (np. ciecierzyca, soczewica).
-
Tłuszcz – cenny składnik stabilizujący glikemię
Choć tłuszcze same w sobie nie podnoszą poziomu glukozy we krwi, ich obecność w posiłku znacząco wpływa na tempo trawienia i wchłaniania węglowodanów. Dodatek zdrowych tłuszczów powoduje wolniejsze opróżnianie żołądka, co sprzyja bardziej stopniowemu wzrostowi glikemii i pomaga unikać nagłych spadków cukru.
Tłuszcze zwiększają również uczucie sytości, co zmniejsza ryzyko nadmiernego jedzenia i podjadania między posiłkami. Dobrym źródłem zdrowych tłuszczów są m.in. oliwa z oliwek extra virgin, awokado, orzechy i migdały, nasiona (np. dyni, słonecznika, chia), tłuste ryby (np. łosoś, makrela, sardynki).
Sposób obróbki termicznej i dojrzałość produktów – na co zwracać uwagę?
To, jak przygotowujemy posiłki, oraz stopień dojrzałości niektórych produktów również wpływają na glikemię poposiłkową. Produkty rozgotowane, mocno rozdrobnione lub wysoko przetworzone mają wyższy indeks glikemiczny (IG), ponieważ są szybciej trawione i wchłaniane. Dla przykładu: rozgotowana marchew, biały ryż czy płatki owsiane błyskawiczne podnoszą glukozę szybciej niż ich mniej przetworzone odpowiedniki — surowa marchew, ryż brązowy czy płatki owsiane górskie.
Warto też pamiętać, że stopień dojrzałości niektórych produktów, szczególnie owoców (np. bananów), wpływa na ich IG — im bardziej dojrzały owoc, tym wyższy IG. Przykładowo: zielony banan zawiera więcej skrobi opornej i ma niższy IG niż bardzo dojrzały, miękki banan, który zawiera więcej cukrów prostych.
Dodatkowo, chłodzenie ugotowanych produktów skrobiowych (np. makaronu, ziemniaków) sprzyja powstawaniu skrobi opornej — frakcji węglowodanów, która nie jest trawiona w jelicie cienkim, co powoduje wolniejszy i bardziej kontrolowany wzrost poziomu glukozy we krwi.
Kolejność jedzenia a hipoglikemia reaktywna – prosty sposób na stabilniejszą glikemię
Nie tylko to co jemy, ale również w jakiej kolejności spożywamy składniki posiłku, może wpływać na poposiłkowy poziom glukozy. Coraz więcej badań wskazuje, że kolejność jedzenia poszczególnych makroskładników ma istotne znaczenie w kontroli glikemii, również u osób z hipoglikemią reaktywną.
Rozpoczynanie posiłku od warzyw, następnie spożywanie źródeł białka i tłuszczu, a na końcu węglowodanów, spowalnia tempo wchłaniania glukozy i zmniejsza gwałtowny wyrzut insuliny po jedzeniu. Taka sekwencja składników może pomóc uniknąć nagłego wzrostu i późniejszego spadku poziomu cukru, które są typowe dla hipoglikemii poposiłkowej.
Przykład praktyczny: zamiast zaczynać obiad od ziemniaków czy ryżu, najpierw zjedz porcję warzyw (np. sałatkę lub gotowane brokuły), potem kawałek mięsa lub ryby, a na końcu dodatek skrobiowy. Taki układ składników wspiera stabilizację glikemii. To prosta, skuteczna strategia — zwłaszcza u osób, które mimo odpowiedniego doboru produktów nadal doświadczają objawów hipoglikemii reaktywnej.
Na co uważać w diecie przy hipoglikemii reaktywnej?
Odpowiednie żywienie w hipoglikemii reaktywnej to nie tylko pytanie co jeść – równie ważne jest unikanie błędów, które mogą nasilać objawy lub wywoływać kolejne spadki glukozy. Zwróć uwagę na:
- Alkohol
Spożycie alkoholu może zaburzać równowagę glikemiczną, ponieważ hamuje proces glukoneogenezy – czyli wytwarzania glukozy z innych źródeł niż węglowodany – zachodzący w wątrobie. Może to prowadzić do niedocukrzenia, zwłaszcza jeśli alkohol jest spożywany bez towarzyszącego posiłku lub na czczo. U osób z tendencją do hipoglikemii szczególną ostrożność należy zachować przy piciu alkoholu wieczorem, ponieważ może to prowadzić do spadków glukozy w nocy lub nad ranem. - Kofeinę
U niektórych osób duże ilości kofeiny mogą nasilać objawy takie jak niepokój, drżenie rąk czy kołatanie serca, które są podobne do objawów hipoglikemii — co może prowadzić do trudności w ich odróżnieniu. Dodatkowo kofeina może wpływać na metabolizm glukozy i wydzielanie insuliny, choć efekt ten może być osobniczo zmienny. Warto obserwować swoje reakcje i — jeśli objawy się nasilają — ograniczyć spożycie kawy lub napojów energetycznych. - Całkowite ograniczanie węglowodanów
Choć ograniczenie spożycia cukru jest uzasadnione, całkowita eliminacja węglowodanów w diecie nie jest dobrym rozwiązaniem w przypadku hipoglikemii reaktywnej. Węglowodany są głównym źródłem energii dla organizmu i ich brak może prowadzić do wahań glikemii oraz pogorszenia samopoczucia. Kluczem jest dobór odpowiednich źródeł — węglowodanów o niskim indeksie i ładunku glikemicznym — oraz ich właściwe rozłożenie w ciągu dnia. - Unikanie słodkich napojów i soków
Produkty zawierające duże ilości cukrów — jak napoje gazowane, soki owocowe, słodzone herbaty — powodują bardzo szybki wzrost poziomu glukozy, a w konsekwencji równie szybki spadek w wyniku nadmiernego wyrzutu insuliny. Mogą więc prowokować objawy hipoglikemii reaktywnej. Nawet jeśli wydają się pomagać w chwili osłabienia, ich efekt jest krótkotrwały i często prowadzi do tzw. efektu „odbicia”.
Czym słodzić przy hipoglikemii reaktywnej?
W przypadku potrzeby dosładzania napojów lub potraw warto sięgać po zamienniki cukru, takie jak erytrytol, ksylitol (z umiarem, może działać przeczyszczająco) czy stevia. Nie podnoszą one poziomu glukozy we krwi i mogą być stosowane jako alternatywa dla tradycyjnego cukru.
Zasady zdrowego odżywiania w hipoglikemii reaktywnej
W hipoglikemii reaktywnej zalecana jest dieta oparta na produktach o niskim indeksie glikemicznym (IG), z odpowiednią ilością błonnika i białka. Najlepsze efekty daje model żywienia inspirowany dietą śródziemnomorską – stabilizuje poziom glukozy i pomaga zapobiegać spadkom cukru po posiłkach.
Dieta o niskim indeksie glikemicznym (IG) w hipoglikemii reaktywnej
To jeden z najskuteczniejszych sposobów na zapobieganie hipoglikemii reaktywnej. Taki model żywienia polega na wyborze produktów, które powodują powolny i stabilny wzrost glukozy po posiłku, dzięki czemu minimalizują ryzyko jej nagłego spadku.
W praktyce dieta o niskim IG obejmuje m.in.:
- warzywa nieskrobiowe (np. brokuły, cukinia, papryka),
- pełnoziarniste produkty zbożowe (np. kasza gryczana, płatki owsiane),
- rośliny strączkowe (soczewica, ciecierzyca),
- niewielkie ilości owoców o niskim IG (np. jagody, grejpfrut),
- źródła zdrowych tłuszczów i białka (np. ryby, jajka, orzechy).
Taki sposób żywienia pomaga utrzymać stały poziom energii, ograniczyć objawy niskiego cukru (drżenie rąk, senność, głód) i w dłuższej perspektywie wspiera regulację gospodarki glukozowej.
Zdjęcie 10. Przykładowe produkty o niskim indeksie glikemicznym
Rośliny strączkowe (soczewica, ciecierzyca, fasola), warzywa nieskrobiowe (cukinia, ogórek, brokuł, bakłażan), owoce w całości, orzechy i gorzka czekolada zwykle mają niższy indeks i/ lub ładunek glikemiczny, dzięki czemu wolniej podnoszą cukier. Pamiętaj, że liczy się porcja i towarzystwo na talerzu – np. biały ryż czy suszone owoce zwiększają glikemię szybciej, więc jedz je w mniejszych ilościach i łącz z białkiem oraz zdrowymi tłuszczami.
Dieta śródziemnomorska a hipoglikemia reaktywna
Dieta śródziemnomorska, oparta na tradycyjnym sposobie żywienia krajów południowej Europy, jest jednym z najlepiej przebadanych modeli żywieniowych. Wspiera regulację gospodarki węglowodanowej, poprawia kontrolę glikemii poposiłkowej i może pomóc w zapobieganiu hipoglikemii reaktywnej.
Ten sposób żywienia charakteryzuje się:
- wysokim spożyciem warzyw, owoców, roślin strączkowych i pełnoziarnistych produktów zbożowych,
- obecnością oliwy z oliwek jako głównego tłuszczu,
- regularnym spożyciem ryb, owoców morza i orzechów,
- umiarkowaną ilością nabiału i jaj,
- ograniczeniem mięsa czerwonego i produktów wysoko przetworzonych.
Dieta śródziemnomorska jest naturalnie bogata w błonnik, zdrowe tłuszcze i przeciwutleniacze, a jednocześnie uboga w produkty o wysokim indeksie glikemicznym. Dzięki temu pomaga utrzymać stabilny poziom glukozy we krwi, poprawia insulinowrażliwość i łagodzi objawy hipoglikemii reaktywnej, takie jak zmęczenie, zawroty głowy czy nagły głód.
10. Przykładowy jadłospis w hipoglikemii reaktywnej
Poniżej znajdziesz przykładowy, 3-dniowy jadłospis przy hipoglikemii reaktywnej, opracowany przez dietetyków Made By Diet®. Został stworzony w oparciu o zasady diety z niskim indeksem glikemicznym, z odpowiednią ilością białka, błonnika i zdrowych tłuszczów. Jego celem jest zapobieganie hipoglikemii reaktywnej, czyli ograniczenie nagłych spadków glukozy po posiłkach, które mogą prowadzić do takich dolegliwości jak senność, rozdrażnienie czy inne objawy niskiego cukru.
Traktuj ten jadłospis jako inspirację – możesz go dostosować do swoich preferencji i stylu życia. Jeśli nie masz pewności, które produkty i porcje będą najlepsze w Twoim przypadku, skonsultuj się z dietetykiem. W Made By Diet® mamy duże doświadczenie w pracy z osobami z hipoglikemią reaktywną i z przyjemnością pomożemy ułożyć plan żywieniowy, który realnie poprawia samopoczucie i daje długoterminowe efekty.
Umów się na konsultację z dietetykiem
Dzień 1
| Produkt | Wielkość porcji | Sposób przygotowania |
| Śniadanie – Sałatka grecka | ||
| Mix sałat | 25 g (1 garść) | 1. Umyj i pokrój warzywa na małe kawałki. 2. Przełóż wszystkie składniki do miseczki i dopraw do smaku. 3. Na wierzchu ułóż plastry sera feta. 4. Zacznij posiłek od sałatki a następnie sięgnij po pieczywo. |
| Pomidor czerwony | 80 g (0.5 sztuki) | |
| Ogórek | 90 g (0.5 sztuki) | |
| Cebula czerwona | 45 g (0.5 sztuki) | |
| Oliwki czarne marynowane | 30 g (2 łyżki) | |
| Oregano suszone | 1 g (1 łyżeczka) | |
| Ser Feta | 80 g (4 plastry) | |
| Chleb żytni | 70 g (2 kromki) | |
| II śniadanie – Gruszka, orzechy włoskie | ||
| Gruszka | 160 g (1 mała sztuka) | 1. Zacznij posiłek od orzechów. |
| Orzechy włoskie | 30 g (1 garść) | |
| Obiad – Zapiekanka makaronowa z indykiem i brokułami | ||
| Indyk filet | 100 g (0.5 sztuki) | 1. Pokrój mięso w kostkę. Dopraw solą, pieprzem oraz przeciśniętym przez praskę czosnkiem, wymieszaj z oliwą. Wrzuć na rozgrzaną patelnię i krótko podsmaż, następnie dodaj szpinak i poczekaj, aż zmniejszy objętość. Przełóż do naczynia żaroodpornego. 2. Przygotuj sos serowy: do rondelka wlej mleko, dodaj starty parmezan, sól, pieprz i gałkę muszkatołową. Delikatnie podgrzewaj, mieszając rózgą, aż sos będzie jednolity. 3. Zdejmij z ognia i wymieszaj z mięsem w naczyniu żaroodpornym. 4. Ugotuj makaron w osolonej wodzie, skracając czas gotowania o około 1-2 minuty. Wyłów go łyżką cedzakową i dodaj do indyka. 5. Rozgrzej piekarnik do 190°C. 6. Do wody po makaronie wrzuć pokrojonego w małe części brokuła i gotuj około 3 minuty. Odcedź i dodaj do formy z indykiem i makaronem. 7. Wszystkie składniki w formie żaroodpornej wymieszaj. Wstaw do piekarnika i zapiekaj bez przykrycia przez 15 minut. 8. W międzyczasie przygotuj sałatkę z rukoli, ogórka i oliwek. Dopraw solą i pieprzem. 9. Zacznij posiłek od sałatki, a następnie sięgnij po zapiekankę. |
| Czosnek | 4 g (1 ząbek) | |
| Oliwa z oliwek | 10 g (2 łyżeczki) | |
| Szpinak | 25 g (1 garść) | |
| Mleko 1,5% | 75 g (0.3 szklanki) | |
| Ser Parmezan | 10 g (2.5 łyżeczki) | |
| Sól | 1 g (szczypta) | |
| Pieprz czarny | 1 g (szczypta) | |
| Gałka muszkatołowa mielona | 1 g (0.5 łyżeczki) | |
| Makaron pełnoziarnisty | 50 g | |
| Brokuł | 60 g (3 różyczki) | |
| Rukola | 40 g (2 garści) | |
| Ogórek | 90 g (0.5 sztuki) | |
| Oliwki czarne marynowane | 15 g (1 łyżka) | |
| Podwieczorek – Sałatka ze świeżych warzyw z tuńczykiem | ||
| Cebula czerwona | 20 g (1 plaster) | 1. Pokrój warzywa na mniejsze kawałki. 2. Wymieszaj wszystkie składniki na sałatkę. 3. Zjedz sałatkę przegryzając grzanką z pieczywa. |
| Oliwki czarne marynowane | 15 g | |
| Pomidor czerwony | 90 g (1 mała sztuka) | |
| Ogórek | 90 g (0.5 sztuki) | |
| Oliwa z oliwek | 5 g (1 łyżeczka) | |
| Mix sałat | 25 g (1 garść) | |
| Tuńczyk w puszce | 60 g (0.5 puszki) | |
| Pestki dyni | 5 g (1 łyżeczka) | |
| Chleb żytni | 35 g (1 kromka) | |
| Kolacja – Omlet z cukinią, pieczarkami i grzankami | ||
| Cukinia | 125 g (0.5 mała sztuka) | 1. Pokrój cukinię, pieczarki i cebulę, a następnie podsmaż na oliwie. 2. Wbij do miseczki jajka, dopraw solą i pieprzem, dokładnie wymieszaj. 3. Rozłóż podsmażone warzywa równo na całej patelni i wlej masę jajeczną. 4. Przykryj pokrywką i usmaż omlet. 5. Gotowy omlet posyp czarnuszką, rukolą i przekrojonymi w ćwiartki pomidorkami. 6. Z pieczywa przygotuj grzanki i posmaruj hummusem. |
| Pieczarki | 30 g (3 małe sztuki) | |
| Cebula | 35 g (0.5 mała sztuka) | |
| Oliwa z oliwek | 5 g (1 łyżeczka) | |
| Jaja kurze | 100 g (2 średnie sztuki) | |
| Czarnuszka | 2 g (2 szczypty) | |
| Rukola | 15 g (0.8 garści) | |
| Pomidory koktajlowe | 50 g (0.5 garści) | |
| Chleb żytni | 35 g (1 kromka) | |
| Hummus | 20 g (1 łyżka) | |
| Wartości odżywcze | 1982 kcal | Białko: 109 g | Tłuszcze: 94 g | Węglowodany: 193 g | Błonnik: 35 g | | |
Dzień 2
| Produkt | Wielkość porcji | Sposób przygotowania |
| Śniadanie – Cynamonowa owsianka z jabłkiem | ||
| Płatki owsiane | 40 g (4 łyżki) | 1. Ugotuj płatki owsiane na mleku do preferowanej konsystencji. 2. Dodaj jogurt i cynamon. 3. Posyp jabłkiem i orzechami. |
| Mleko 1,5% | 100 g | |
| Skyr naturalny | 150 g (1 opakowanie) | |
| Cynamon mielony | 2 g (2 szczypty) | |
| Jabłko | 70 g (0.5 sztuki) | |
| Orzechy włoskie | 24 g (6 sztuk) | |
| II śniadanie – Jabłko, migdały | ||
| Jabłko | 110 g (1 mała sztuka) | 1. Płatki owsiane wsyp do gotującego się mleka i gotuj aż zgęstnieją. 2. Do gotowej owsianki dodaj jogurt i cynamon. 3. Posyp pokrojonym w kostkę jabłkiem, posiekanymi orzechami i szczyptą cynamonu. |
| Migdały | 45 g (1.5 garści) | |
| Obiad – Azjatycki makaron w sosie orzechowym z tofu | ||
| Makaron spaghetti pełnoziarnisty | 40 g | 1. Ugotuj makaron w sposób al dente (70 ml wody po ugotowaniu odłóż na bok). 2. Podsmaż mieszankę warzyw na oliwie z oliwek. 3. Pokrój tofu w kostkę, wymieszaj z ulubionymi przyprawami (np. pieprz, czosnek granulowany, papryka) i piecz przez 15 minut w piekarniku nagrzanym do 180°C. 4. Wymieszaj sos sojowy, miód, masło orzechowe, sok z cytryny, przeciśnięty przez praskę czosnek, imbir oraz odłożoną wodę z gotowania makaronu. 5. Połącz sos z warzywami, makaronem i tofu. 6. Posyp posiekanym szczypiorkiem. |
| Woda | 70 ml | |
| Oliwa z oliwek | 5 g (1 łyżeczka) | |
| Warzywa na patelnię azjatyckie | 200 g | |
| Tofu naturalne | 90 g (0.5 opakowania) | |
| Sos sojowy | 10 g (1 łyżka) | |
| Miód | 6 g (0.5 łyżeczki) | |
| Masło orzechowe 100% | 15 g (1 łyżeczka) | |
| Sok z cytryny | 3 g (1 łyżeczka) | |
| Czosnek | 4 g (1 ząbek) | |
| Imbir mielony | 2 g (1 łyżeczka) | |
| Szczypiorek | 5 g (1 łyżka) | |
| Podwieczorek – Kanapka z szynką, warzywa z hummusem | ||
| Szynka z indyka | 30 g (2 plastry) | 1. Na pieczywo nałóż szynkę i sałatę. 2. Pokrój warzywa w słupki i zjedz z hummusem. 3. Zacznij posiłek od warzyw z hummusem a następnie zjedz pieczywo. |
| Sałata masłowa | 10 g (2 liście) | |
| Hummus | 60 g (3 łyżki) | |
| Ogórek | 90 g (0.5 sztuki) | |
| Chleb żytni | 35 g (1 kromka) | |
| Papryka czerwona | 60 g (0.5 średniej sztuki) | |
| Kolacja – Sałatka a’la tabbouleh z mozzarellą | ||
| Kasza bulgur | 30 g (3 łyżki) | 1. Ugotuj kaszę zgodnie z instrukcją na opakowaniu. 2. Drobno posiekaj wszystkie warzywa i zioła. 3. Dodaj sok z cytryny, oliwę i przyprawy. 4. Wymieszaj warzywa z ugotowaną i ostudzoną kaszą, mozzarellą pokrojoną w kostkę oraz pestki dyni. 5. Przed podaniem schłódź w lodówce przez około 30 minut. |
| Ogórek | 90 g (0.5 sztuki) | |
| Rzodkiewka | 45 g (3 sztuki) | |
| Natka pietruszki | 24 g (2 łyżki) | |
| Szczypiorek | 10 g (2 łyżki) | |
| Oliwa z oliwek | 10 g (2 łyżeczki) | |
| Sok z cytryny | 12 g (2 łyżki) | |
| Ser Mozzarella light 9% | 63 g (0.5 sztuki) | |
| Pestki dyni | 10 g (1 łyżka) | |
| Wartości odżywcze | 2022 kcal | Białko: 104 g | Tłuszcze: 101 g | Węglowodany: 201 g | Błonnik: 42 g | | |
Dzień 3
| Produkt | Wielkość porcji | Sposób przygotowania |
| Śniadanie – Kasza z fasolką edamame i fetą | ||
| Kasza bulgur | 30 g (3 łyżki) | 1. Ugotuj kaszę zgodnie z instrukcją na opakowaniu. 2. W osolonej wodzie oddzielnie ugotuj edamame do miękkości (ok. 4-5 min) i wyłuskaj ze strączków. 3. Warzywa pokrój na małe kawałki. 4. Wymieszaj wszystkie składniki w miseczce. 5. Na koniec dodaj rukolę i dopraw octem balsamicznym. |
| Edamame | 113 g (1.5 porcji) | |
| Awokado | 45 g (3 plastry) | |
| Pomidory koktajlowe | 100 g (5 sztuk) | |
| Ser Feta | 60 g (3 plastry) | |
| Ocet balsamiczny | 6 g (1 łyżka) | |
| Rukola | 20 g (1 garść) | |
| II śniadanie – Jogurt z malinami i orzechami laskowymi | ||
| Jogurt naturalny 2% | 150 g (1 małe opakowanie) | 1. Jogurt połącz z płatkami owsianymi, owocami i siekanymi orzechami. |
| Płatki owsiane | 10 g (1 łyżka) | |
| Maliny | 50 g | |
| Orzechy laskowe | 20 g (1.3 łyżki) | |
| Obiad – Bowl z pieczonym łososiem, ryżem i guacamole | ||
| Ryż brązowy | 45 g (3 łyżki) | 1. Ugotuj ryż zgodnie z instrukcją na opakowaniu. 2. Skrop łososia sokiem z cytryny, dopraw świeżo mielonym pieprzem, przełóż do naczynia żaroodpornego lub zawiń w papier do pieczenia i piecz w piekarniku nagrzanym do 200°C przez 20-25 minut (do uzyskania jasnoróżowej barwy). 3. Włóż do miski opłukany i osuszony szpinak, następnie ułóż ryż, gotowego łososia, pastę z awokado, przekrojone na pół pomidorki i plasterki ogórka. 4. Dopraw do smaku solą i pieprzem. Posyp odrobiną czarnuszki i kiełkami. 5. Zacznij posiłek od warzyw i łososia, a następnie sięgnij po ryż. |
| Łosoś atlantycki | 100 g (0.5 sztuki) | |
| Sok z cytryny | 3 g (1 łyżeczka) | |
| Pieprz czarny | 2 g (2 szczypty) | |
| Szpinak | 50 g (2 garści) | |
| Awokado | 45 g (3 plastry) | |
| Pomidory koktajlowe | 50 g (0.5 garści) | |
| Ogórek | 90 g (0.5 sztuki) | |
| Sól | 1 g (szczypta) | |
| Czarnuszka | 2 g (2 szczypty) | |
| Jarmuż kiełki | 15 g (1 garść) | |
| Podwieczorek – Serek wiejski z rzodkiewką | ||
| Rzodkiewka | 75 g (5 sztuk) | 1. Posiekaj warzywa i wymieszaj z serkiem wiejskim. 2. Posyp całość ziarnami słonecznika (możesz je wcześniej lekko podprażyć na patelni). 3. Zacznij posiłek od serka z warzywami, a następnie sięgnij po pieczywo. |
| Szczypiorek | 5 g (1 łyżka) | |
| Serek wiejski lekki | 200 g (1 opakowanie) | |
| Nasiona słonecznika | 8 g (2 łyżeczki) | |
| Chleb żytni | 35 g (1 kromka) | |
| Kolacja – Szakszuka z jarmużem, ciecierzycą i parmezanem | ||
| Oliwa z oliwek | 10 g (2 łyżeczki) | 1. Na oliwie podsmaż czosnek pokrojony w cienkie plasterki. 2. Dodaj pomidory z puszki oraz przyprawy. 3. Dodaj jarmuż, wcześniej oddzielając liście od twardych łodyg. 4. Wsyp odsączoną z zalewy ciecierzycę i wbij jajko. Przykryj pokrywką i smaż przez około 3 minuty lub do czasu, aż białko się zetnie. 5. Dopraw solą i pieprzem, posyp tartym parmezanem i posiekanym szczypiorkiem. |
| Czosnek | 4 g (1 ząbek) | |
| Pomidory krojone w puszce | 120 g (8 łyżek) | |
| Kurkuma mielona | 2 g (2 szczypty) | |
| Słodka papryka przyprawa | 2 g (2 szczypty) | |
| Chili w proszku | 2 g (2 szczypty) | |
| Sól | 1 g (szczypta) | |
| Pieprz czarny | 1 g (szczypta) | |
| Jarmuż | 30 g (1 garść) | |
| Ciecierzyca w puszce odsączona | 100 g (5 łyżek) | |
| Jajo kurze | 50 g (1 sztuka) | |
| Ser Parmezan | 8 g (2 łyżeczki) | |
| Szczypiorek | 10 g (2 łyżki) | |
| Wartości odżywcze | 1983 kcal | Białko: 114 g | Tłuszcze: 96 g | Węglowodany: 183 g | Błonnik: 45 g | |
11. Hipoglikemia reaktywna w szczególnych sytuacjach
Hipoglikemia reaktywna u większości osób pojawia się po posiłku w podobny sposób – nadmierny wyrzut insuliny prowadzi do spadku stężenia glukozy we krwi. Jednak w pewnych sytuacjach fizjologicznych lub klinicznych mechanizm ten może wyglądać inaczej, a ryzyko niedocukrzenia bywa wyższe.
Do takich szczególnych przypadków należą m.in.: hipoglikemia reaktywna w ciąży (zwłaszcza po operacjach bariatrycznych), hipoglikemia reaktywna u osób z nadwagą i otyłością oraz hipoglikemia reaktywna u sportowców. W każdej z tych grup objawy i przyczyny mogą się różnić, a także wymagać nieco innych zasad diagnostyki i modyfikacji diety.
Hipoglikemia reaktywna a ciąża
Hipoglikemia, czyli zbyt niski poziom cukru we krwi, w ciąży zdarza się rzadko i zwykle dotyczy kobiet z chorobami metabolicznymi lub hormonalnymi. Zupełnie inną sytuacją jest hipoglikemia reaktywna, czyli spadek glukozy po posiłku. Badania pokazują, że u części ciężarnych można ją zaobserwować podczas rutynowego testu obciążenia glukozą (OGTT) wykonywanego między 24. a 28. tygodniem ciąży. Szacuje się, że takie epizody występują u kilku do kilkunastu procent kobiet.
Hipoglikemia reaktywna w ciąży po operacji bariatrycznej
Szczególną uwagę trzeba zwrócić w przypadku kobiet, które przed ciążą przeszły operację bariatryczną (np. gastric bypass czy sleeve gastrectomy). U nich po posiłku może dojść do gwałtownego wyrzutu insuliny i późniejszego, nagłego spadku cukru we krwi. Objawy hipoglikemii (np. osłabienie, zawroty głowy, drżenie rąk, uczucie niepokoju) mogą pojawiać się właśnie w tym okresie i być bardziej dokuczliwe.
Warto też wiedzieć, że u ciężarnych po operacjach bariatrycznych standardowy test obciążenia glukozą (OGTT), stosowany rutynowo w diagnostyce cukrzycy ciążowej, może być mylący – a nawet wywołać głęboką hipoglikemię, której nie ma po zwykłych posiłkach. Dlatego w takich sytuacjach lepiej sprawdza się test posiłkowy (MMTT), w którym monitoruje się reakcję organizmu po spożyciu standardowego posiłku (np. pieczywa z dodatkiem nabiału czy jajka).
Dlaczego hipoglikemia reaktywna w ciąży jest niebezpieczna?
Powtarzające się epizody hipoglikemii mają znaczenie kliniczne zarówno dla mamy, jak i dla dziecka:
- U mamy niskie poziomy cukru powodują osłabienie, rozdrażnienie, problemy z koncentracją czy poczucie niepokoju – co utrudnia codzienne funkcjonowanie.
- U dziecka niedobory glukozy mogą zaburzać tempo wzrastania w macicy i zwiększać ryzyko urodzenia się z niższą masą ciała.
Dlatego w przypadku pojawiających się objawów warto skonsultować się z lekarzem prowadzącym oraz dietetykiem. Odpowiednio dobrane posiłki i regularne monitorowanie poziomu glukozy pozwalają znacznie zmniejszyć ryzyko epizodów hipoglikemii i zadbać o bezpieczeństwo zarówno mamy, jak i dziecka.
Hipoglikemia reaktywna a nadwaga i otyłość
Nadwaga i otyłość są stanami, które w istotny sposób zwiększają ryzyko wystąpienia hipoglikemii reaktywnej. Wraz ze wzrostem masy ciała nasilają się zaburzenia gospodarki węglowodanowo-insulinowej, a jednym z ich następstw jest większa podatność na niedocukrzenia po posiłkach. Badania wskazują, że częstość hipoglikemii poposiłkowej rośnie wraz ze wzrostem wskaźnika masy ciała (BMI – ang. Body Mass Index).
Mechanizmy hipoglikemii reaktywnej w otyłości
Kluczowym mechanizmem stojącym za tym zjawiskiem jest insulinooporność, czyli obniżona wrażliwość tkanek — przede wszystkim mięśni i tkanki tłuszczowej — na działanie insuliny. Otyłość, zwłaszcza brzuszna, jest jednym z głównych czynników prowadzących do jej rozwoju. Organizm, chcąc utrzymać prawidłowy poziom glukozy we krwi, reaguje zwiększonym wydzielaniem insuliny, co prowadzi do przewlekłej hiperinsulinemii. Z czasem powstaje błędne koło: nadmiar tkanki tłuszczowej sprzyja insulinooporności, a insulinooporność utrudnia kontrolę masy ciała, co ostatecznie zwiększa ryzyko epizodów hipoglikemii reaktywnej po posiłkach.
Jak przebiegają objawy hipoglikemii reaktywnej u osób z nadmierną masą ciała?
Objawy hipoglikemii reaktywnej są takie same jak u osób szczupłych (→ zob. Rozdział 2: Jakie są objawy hipoglikemii reaktywnej?). Różnica polega jednak na tym, że u osób z nadwagą i otyłością epizody występują częściej i bywają bardziej nasilone.
Dzieje się tak dlatego, że insulinooporność wymusza na trzustce wydzielanie większych ilości insuliny – często z opóźnieniem. W efekcie po posiłku dochodzi najpierw do gwałtownego skoku glukozy, a następnie do zbyt silnego i przedłużonego działania insuliny, które obniża poziom cukru poniżej normy. Takie „huśtawki glikemiczne” mogą powtarzać się niemal po każdym posiłku bogatszym w węglowodany, co tłumaczy, dlaczego osoby z nadmierną masą ciała doświadczają hipoglikemii reaktywnej znacznie częściej niż osoby szczupłe.
Hipoglikemia reaktwyna u sportowców
U osób aktywnych fizycznie hipoglikemia może pojawić się na skutek nakładania się dwóch procesów:
- Naturalnego wyrzutu insuliny po posiłku zawierającym węglowodany,
- zwiększonego poboru glukozy przez mięśnie w trakcie wysiłku (transport GLUT-4 aktywowany skurczem mięśni, niezależnie od insuliny →zob. okno anaboliczne).
Warto podkreślić, że nie każde niedocukrzenie podczas treningu to hipoglikemia reaktywna. Spadki glukozy w czasie dłuższej aktywności bez związku z posiłkiem określamy jako hipoglikemię wysiłkową. Największe ryzyko reaktywnej hipoglikemii dotyczy sytuacji, gdy intensywny trening rozpoczyna się krótko po posiłku bogatym w węglowodany o wysokim IG – wtedy oba mechanizmy działają jednocześnie.
Objawy hipoglikemii reaktywnej u sportowców
Stężenie glukozy we krwi może spadać szybko, szczególnie w pierwszych minutach wysiłku. U osób bez cukrzycy obserwuje się czasem spadki poniżej 70 mg/dl (a sporadycznie nawet 50–60 mg/dl), choć nie zawsze towarzyszą im objawy. Część sportowców dobrze toleruje niższe wartości glukozy, natomiast inni zgłaszają zawroty głowy, osłabienie czy trudności z koncentracją nawet przy wartościach mieszczących się w normie.
Ryzyko wczesnego „zjazdu” rośnie m.in. po dużej porcji węglowodanów o wysokim IG zjedzonej 30–90 minut przed treningiem. Co ciekawe, wraz ze wzrostem intensywności wysiłku organizm zwykle uruchamia mechanizmy obronne – wydzielanie adrenaliny i glukagonu – które nasilają produkcję glukozy w wątrobie. Dzięki temu część sportowców zauważa, że objawy hipoglikemii łagodnieją lub ustępują po kilkunastu minutach kontynuowania ćwiczeń.
Jak zapobiegać hipoglikemii reaktywnej u sportowców?
Całkowite wyeliminowanie reaktywnej hipoglikemii nie zawsze jest możliwe, ponieważ odpowiedź organizmu na spożycie węglowodanów i obciążenie treningowe jest indywidualna. Istnieją jednak sprawdzone strategie, które mogą znacząco zmniejszyć częstość epizodów:
- 2 godziny przed treningiem – posiłek powinien zawierać węglowodany o niskim IG (np. pełnoziarniste kasze, pieczywo, płatki owsiane) oraz źródło białka. Podaż tłuszczów powinna być umiarkowana, ponieważ spowalniają opróżnianie żołądka i mogą utrudniać wykorzystanie węglowodanów w trakcie wysiłku. Unikaj dużych porcji węglowodanów o wysokim IG na 30–90 min przed startem.
- Bezpośrednio przed treningiem (ostatnie 10–15 minut lub rozgrzewka) – dobrym wyborem będzie 15–30 g łatwo przyswajalnych węglowodanów, które szybko się wchłaniają i nie obciążają przewodu pokarmowego (napoje izotoniczne, żele węglowodanowe, dojrzały banan).
- Połączenie obu podejść – główny posiłek kilka godzin przed wysiłkiem stanowi podstawowe źródło energii, a mała porcja węglowodanów tuż przed treningiem może pomóc uniknąć gwałtownego spadku glikemii na początku aktywności. Warto też zaczynać od kilku minut lżejszej rozgrzewki i stopniowo zwiększać intensywność.
- Stopniowe zwiększanie intensywności – rozpoczęcie od spokojnej rozgrzewki i wejście w wyższe obciążenia pomaga organizmowi uruchomić mechanizmy obronne i zmniejszyć ryzyko hipoglikemii.
W przypadku nawracających epizodów lub niepewności co do żywienia przedtreningowego warto skonsultować plan posiłków i nawadniania z doświadczonym dietetykiem sportowym.
Zdjęcie 11. Hipoglikemia u sportowców
U sportowców spadek stężenia cukru we krwi na początku wysiłku wynika z połączenia poposiłkowego wyrzutu insuliny i zwiększonego poboru glukozy przez mięśnie. Choć mechanizm ten nie jest klasyczną hipoglikemią reaktywną, objawy – takie jak osłabienie, zawroty głowy czy problemy z koncentracją – mogą być podobne.
12. Podsumowanie
Hipoglikemia reaktywna to nie tylko chwilowe „zjazdy energii” po posiłku – to sygnał, że organizm może mieć problem z utrzymaniem stabilnego poziomu glukozy. Choć nie jest to jednostka chorobowa taka jak cukrzyca typu 1 czy typu 2, należy do szerszego spektrum zaburzeń gospodarki glukozy, które warto dobrze zrozumieć i zaopiekować się nimi na co dzień.
Kluczowe znaczenie ma rozpoznanie hipoglikemii reaktywnej i zrozumienie, jak działają mechanizmy wpływające na niskie stężenie glukozy po posiłku. Dobrze dobrana dieta – z odpowiednim indeksem i ładunkiem glikemicznym, właściwą objętością oraz czasem spożycia posiłków – to najważniejsze narzędzie w radzeniu sobie z tym problemem. Jeśli więc masz podejrzenie tego zaburzenia, dieta powinna być Twoim pierwszym krokiem ku lepszemu samopoczuciu.
W Made By Diet® mamy duże praktyczne doświadczenie w pracy z osobami z hipoglikemią reaktywną – pomogliśmy już wielu pacjentom odzyskać energię i stabilność glikemii. Z przyjemnością pomożemy również Tobie.
Umów się na konsultację z dietetykiem
Pamiętaj, że skuteczne zapobieganie hipoglikemii reaktywnej nie polega wyłącznie na unikaniu słodyczy – to świadome komponowanie codziennego menu, troska o sen, aktywność fizyczną i małe decyzje podejmowane każdego dnia.
U osób, które zrozumieją naturę tej reakcji organizmu, przestrzeganie diety nie jest już przykrym obowiązkiem, a formą odzyskania kontroli nad ciałem i samopoczuciem. Reaktywna może być nie tylko glikemia – ale też Twoje podejście do zdrowia.
13. Bibliografia
- Hyperinsulinism and dysinsulinism. Harris S. JAMA (1924) 83(10):729–33. doi: 10.1001/JAMA.1924.02660100003002; https://jamanetwork.com/journals/jama/article-abstract/231579
- Evaluation and management of adult hypoglycemic disorders: an Endocrine Society Clinical Practice Guideline. Cryer PE, Axelrod L, Grossman AB, Heller SR, Montori VM, Seaquist ER, Service FJ; The Journal of Clinical Endocrinology & Metabolism, Volume 94, Issue 3, 1 March 2009, Pages 709–728, https://doi.org/10.1210/jc.2008-1410; https://academic.oup.com/jcem/article/94/3/709/2596247
- Proposed treatment strategy for reactive hypoglycaemia. Younes YR, Cron N, Field BCT, Nayyar V, Clark J, Zachariah S, Lakshmipathy K, Isuga JO, Maghsoodi N, Emmanuel J. Front Endocrinol (Lausanne). 2024 Feb 2;15:1332702. doi: 10.3389/fendo.2024.1332702. PMID: 38370356; PMCID: PMC10869498. https://www.frontiersin.org/journals/endocrinology/articles/10.3389/fendo.2024.1332702/full
- Textbook of Medical Physiology, Arthur C. Guyton, Michael E. Hall, 15th edition 2025, ELSEVIER https://www.eu.elsevierhealth.com/guyton-and-hall-textbook-of-medical-physiology-9780443111013.html
- Biochemistry Jeremy Berg; Gregory Gatto Jr.; Justin Hines; John L. Tymoczko; Lubert Stryer 10th edition 2023, Macmillan Learning https://www.macmillanlearning.com/ed/uk/product/Biochemistry–10th-edition/p/1319498507
- Fizjologia Człowieka – zintegrowane podejście, Dee Unglaub Silverthorn, Wydawnictwo PZWL, Warszawa 2019 https://pzwl.pl/Fizjologia-czlowieka.-Zintegrowane-podejscie,75276299,p.html
- Hipoglikemia reaktywna jako choroba XXI wieku w ujęciu interdyscyplinarnym [Reactive hypoglycemia-an interdisciplinary approach of the disease of XXI Century]. Hall M, Walicka M, Traczyk I. Wiad Lek. 2020;73(2):384-9. DOI: 10.36740/WLek202002134; https://wiadlek.pl/wp-content/uploads/archive/2020/WLek202002134.pdf
- Metabolic parameters in patients with suspected reactive hypoglycemia. Hall M, Walicka M, Panczyk M, Traczyk I. Journal of Personalized Medicine. 2021;11(4):276. doi: 10.3390/jpm11040276. https://pubmed.ncbi.nlm.nih.gov/33916952/
- Identification of reactive hypoglycemia with different basic BMI and its causes by prolonged oral glucose tolerance test. Lv X, Fang K, Hao W, Han Y, Yang N, Yu Q. Diabetes, Metabolic Syndrome and Obesity. 2020 Dec 2:13:4717-4726. PMID: 33293845 PMCID: PMC7719337 DOI: 10.2147/DMSO.S280084. https://pubmed.ncbi.nlm.nih.gov/33293845/
- Combination of alcohol and glucose consumption as a risk to induce reactive hypoglycemia. Oba‐Yamamoto C, Takeuchi J, Nakamura A, Takikawa R, Ozaki A, Nomoto H, et al. Journal of Diabetes Investigation. 2021 Apr;12(4):651-657. doi: 10.1111/jdi.13375. Epub 2020 Sep 7. https://pubmed.ncbi.nlm.nih.gov/33448697/
- The best defense against hypoglycemia is to recognize it: is caffeine useful? Watson J, Kerr D. Diabetes technology & therapeutics. 1999 Summer;1(2):193-200. doi: 10.1089/152091599317413. https://pubmed.ncbi.nlm.nih.gov/11475292/
- Normal pregnancy-a state of insulin resistance. Sonagra AD, Biradar SM, Dattatreya K, DS JM. Journal of clinical and diagnostic research. 2014 Nov 20;8(11):CC01–CC03. doi: 10.7860/JCDR/2014/10068.5081. https://pmc.ncbi.nlm.nih.gov/articles/PMC4290225/
- Does reactive hypoglycemia during the 100 g oral glucose tolerance test adversely affect perinatal outcomes? Delibas IB, Tanriverdi S, Cakmak B. Ginekologia Polska. 2018;89(1):25-29. doi: 10.5603/GP.a2018.0005. https://pubmed.ncbi.nlm.nih.gov/29411343/
- Współczesna dietoterapia, Lange Ewa, Włodarek Dariusz, PZWL Wydawnictwo Lekarskie, Warszawa 2022 https://pzwl.pl/Wspolczesna-dietoterapia,197971021,p.html
- Long-term treatment with acarbose for the treatment of reactive hypoglycemia. A.G. Özgen, F. Hamulu, F. Bayraktar, S. Cetínkalp, C. Yilmaz, M. Túzún, and T. Kabalak. Eat Weight Disord. 1998 Sep;3(3):136-40. doi: 10.1007/BF03340001. https://pubmed.ncbi.nlm.nih.gov/10728163/
- Assessing Long-Term Impact of Dietary Interventions on Occurrence of Symptoms Consistent with Hypoglycemia in Patients without Diabetes: A One-Year Follow-Up Study. M. Hall, M. Walicka, M. Panczyk, I. Traczyk. Nutrients 2022 Jan 24;14(3):497. doi: 10.3390/nu14030497. https://pubmed.ncbi.nlm.nih.gov/35276856/
- Impact of Nutrient Type and Sequence on Glucose Tolerance: Physiological Insights and Therapeutic Implications. L. Nesti, A. Mengozzi, D.Tricò, 2019, Frontiers in Endocrinology, 10:144. doi:10.3389/fendo.2019.00144. https://pubmed.ncbi.nlm.nih.gov/30906282/
- Carbohydrate-last meal pattern lowers postprandial glucose and insulin excursions in type 2 diabetes. A.P Shukla, J. Andono, S.H Touhamy, A. Casper, R.G Iliescu, E. Mauer, Y.S Zhu, D.S Ludwig, L.J Aronne, 2017, BMJ Open Diabetes Res Care, 5(1):e000440. doi:10.1136/bmjdrc-2017-000440. https://pubmed.ncbi.nlm.nih.gov/28989726/
- Manipulating the sequence of food ingestion improves glycemic control in type 2 diabetic patients under free-living conditions. D Tricò, E Filice, S Trifirò and A Natali, Nutrition & Diabetes (2016) Nutr Diabetes. 2016 Aug 22;6(8):e226. doi: 10.1038/nutd.2016.33. https://pubmed.ncbi.nlm.nih.gov/27548711/
- Fasting Until Noon Triggers Increased Postprandial Hyperglycemia and Impaired Insulin Response After Lunch and Dinner in Individuals With Type 2 Diabetes: A Randomized Clinical Trial. D. Jakubowicz, J. Wainstein, B. Ahren, Z. Landau, Y. Bar-Dayan, O. Froy. Diabetes Care 2015;38(10):1820–1826. doi: 10.2337/dc15-0761. https://pubmed.ncbi.nlm.nih.gov/26220945/
- Treatment of reactive hypoglycemia with the macrobiotic Ma-pi 2 diet as assessed by continuous glucose monitoring: The MAHYP randomized crossover trial. A. Soare, Y. M. Khazrai, L. Fontana, R. D. Toro, M. C. Lazzaro, C. Di Rosa, A. Buldo, E. Fioriti, E. Maddaloni, S. Angeletti, A. Di Mauro, R. Gesuita, E. Skrami, D. Tuccinardi, S. Fallucca, M. Pianesi, P. Pozzilli. Clinical Science Volume 69 p 148-156 April 2017. DOI: 10.1016/j.metabol.2017.01.023. https://www.sciencedirect.com/science/article/abs/pii/S0026049517300331
- Effects of skipping breakfast, lunch or dinner on subsequent postprandial blood glucose levels among healthy young adults. Ch. Kanazawa, Y. Shimba, S. Toyonaga, F. Nakamura, T. Hosaka, Nutrition & Metabolism (2025) 22:76. https://doi.org/10.1186/s12986-025-00975-4. https://nutritionandmetabolism.biomedcentral.com/articles/10.1186/s12986-025-00975-4
- Meal timing, meal frequency, and breakfast skipping in adult individuals with type 1 diabetes – associations with glycaemic control. A. J. Ahola, S. Mutter, C. Forsblom, V. Harjutsalo, per-Henrik Groop, Scientific Reports (2019) 9:20063 | https://doi.org/10.1038/s41598-019-56541-5. https://www.nature.com/articles/s41598-019-56541-5
- The Effects of Breakfast Consumption and Composition on Metabolic Wellness with a Focus on Carbohydrate Metabolism. K. C. Maki, A. K. Phillips-Eakley, K. N. Smith, American Society for Nutrition. Adv Nutr 2016;7(Suppl):613S–21S; doi:10.3945/an.115.010314. https://pmc.ncbi.nlm.nih.gov/articles/PMC4863265/
- Eating Vegetables First Regardless of Eating Speed Has a Significant Reducing Effect on Postprandial Blood Glucose and Insulin in Young Healthy Women: Randomized Controlled Cross-Over Study. S. Imai, S. Kajiyama, K. Kitta, T. Miyawaki, S. Matsumoto, N. Ozasa, S. Kajiyama, Y. Hashimoto, M. Fukui, Nutrients 2023, 15, 1174. https://doi.org/10.3390/nu15051174. https://www.mdpi.com/2072-6643/15/5/1174
- Hypoglycaemia in non-diabetic pregnancy. A. Morton, Obstetric Medicine, 2023, Vol. 16(2) 123–125. https://doi.org/10.1177/1753495X211032787. https://pmc.ncbi.nlm.nih.gov/articles/PMC10334043/
- Identification of Reactive Hypoglycemia with Different Basic BMI and Its Causes by Prolonged Oral Glucose Tolerance Test. Xue Lv, Kun Fang, Wenqing Hao, Yuxin Han, Nailong Yang, Qing Yu. Diabetes Metab Syndr Obes. 2020 Dec 2:13:4717-4726. http://doi.org/10.2147/DMSO.S280084. https://pubmed.ncbi.nlm.nih.gov/33293845/
- Society for Endocrinology guidelines for the diagnosis and management of post-bariatric hypoglycaemia. J. Hazlehurst, B. Khoo, C. B. Lobato, I. Ilesanmi, S. Abbott, T. Chan, S. Pillai, K. Maslin, S. Purkayastha, B. McGowan, R. Andrews, E. Nicholson, K. McCullough, L. Albon, R. Batterham, G. K. Dimitriadis, S. Forbes, G. Bewick, Tricia M-M Tan. Endocrine Connections (2024) 13 e230285. https://doi.org/10.1530/EC-23-0285. https://pubmed.ncbi.nlm.nih.gov/38451861/
- Postprandial Reactive Hypoglycemia. Yüksel Altuntaş. DOI: 10.14744/SEMB.2019.59455. Med Bull Sisli Etfal Hosp 2019;53(3):215–220. https://pmc.ncbi.nlm.nih.gov/articles/PMC7192270/
- The Myths Surrounding Pre-Exercise Carbohydrate Feeding. Asker E. Jeukendrup, Sophie C. Killer. Ann Nutr Metab 2010;57(suppl 2):18–25. DOI: 10.1159/000322698. https://pubmed.ncbi.nlm.nih.gov/21346333/
- Hypoglycemia in Type 2 Diabetes Mellitus patients: A review article, Ayla M. Tourkman, Turki J. Alharbi, Abdulaziz M. Bin Rsheed, Abdulrhamn N. AlRasheed, Saad M AlBattal, Osama Abdelhay, Mohamed A. Hassali, Alian A. Alrasheedy, Nouf G. Al Harbi, Abdulaziz Alqahtani. Diabetes and Metabolic Syndrome: Clinical Research and Reviews (2010), https://doi.org/10.1016/j.dsx.2018.04.004. https://pubmed.ncbi.nlm.nih.gov/29678605/
- Clinical biochemistry and metabolic medicine, Martin A Crook, 18th edition, CRC Press 2019, https://www.routledge.com/Clinical-Biochemistry-and-Metabolic-Medicine/Crook/p/book/9781444144147
- Dietoterapia, Dominika Głąbska, Lucyna Kozłowska, Ewa Lange, Dariusz Włodarek, PZWL Wydawnictwo Lekarskie, Warszawa 2014 https://pzwl.pl/Dietoterapia,4930593,p.html
FAQ
Hipoglikemia reaktywna to stan, w którym poziom glukozy we krwi spada poniżej normy (zwykle <70 mg/dl) 2–5 godzin po posiłku. Wynika to z nieprawidłowej odpowiedzi insulinowej organizmu.
Oznacza nadmierną reakcję na posiłek – trzustka wydziela za dużo insuliny, przez co poziom cukru obniża się zbyt mocno. Nie jest to choroba sama w sobie, ale zaburzenie regulacji metabolizmu glukozy.
Nie, hipoglikemia reaktywna to nie cukrzyca. Może jednak zwiększać ryzyko rozwoju cukrzycy typu 2 w przyszłości.
Hipoglikemia reaktywna występuje u osób bez cukrzycy i wiąże się z poposiłkowym wydzielaniem insuliny. Hipoglikemia cukrzycowa to powikłanie leczenia insuliną lub lekami obniżającymi poziom cukru.
Najczęściej z nadmiernego wyrzutu insuliny po posiłku bogatym w węglowodany. Może też towarzyszyć stanom po operacjach żołądka, insulinooporności czy chorobom hormonalnym.
Nie, hipoglikemia reaktywna nie jest chorobą. To objaw zaburzonej regulacji poziomu glukozy, który może pojawiać się samoistnie lub w przebiegu innych schorzeń.
Hipoglikemia reaktywna może występować jako powikłanie po operacjach bariatrycznych, u osób z insulinoopornością lub na wczesnym etapie rozwoju cukrzycy typu 2. Rzadziej przyczyną spadku glukozy po posiłku są choroby endokrynologiczne, takie jak insulinoma (guz trzustki) czy niedoczynność nadnerczy, które jednak zwykle powodują hipoglikemię na czczo.
Tak. Nawracająca hipoglikemia reaktywna może pogarszać samopoczucie, koncentrację i bezpieczeństwo (np. za kierownicą), a w dłuższej perspektywie wiązać się ze zwiększonym ryzykiem zaburzeń metabolicznych, w tym cukrzycy typu 2. Szczególnie niebezpieczna jest ciężka hipoglikemia u osób z cukrzycą — to sytuacja, gdy cukier spada poniżej 54 mg/dl albo objawy są tak silne, że chory nie jest w stanie sam sobie pomóc; grozi to utratą przytomności i wymaga natychmiastowego podania szybko wchłanianych węglowodanów oraz wezwania pomocy.
Hipoglikemię reaktywną rozpoznaje się, gdy jednocześnie występują trzy elementy tzw. triady Whipple’a: objawy niedocukrzenia (np. drżenie rąk, głód, osłabienie), niski poziom glukozy we krwi (poniżej 70 mg/dl) oraz ustąpienie objawów po spożyciu węglowodanów.
Najczęściej głód, drżenie rąk, kołatanie serca, niepokój i nadmierne pocenie się.
Osłabienie, poty, bladość, zawroty głowy, problemy z koncentracją, a w cięższych przypadkach zaburzenia widzenia czy utrata przytomności.
Tak. Uczucie chłodu, dreszcze i zimne poty to częste objawy niskiego cukru (spadku glukozy we krwi), także w hipoglikemii reaktywnej — wynikają z wyrzutu adrenaliny. Gdy „robi się zimno” przy niskim stężeniu glukozy, przyjmij 10–15 g szybko wchłanianych węglowodanów (np. sok, tabletki glukozy) i skontroluj objawy.
Tak, zawroty głowy są jednym z objawów hipoglikemii, które pojawiają się, gdy mózg otrzymuje mniej glukozy. Zwykle towarzyszą im inne symptomy niedocukrzenia, takie jak drżenie rąk, pocenie się, osłabienie czy nagły głód.
Trzeba potwierdzić objawy, niski poziom glukozy w tym samym czasie i ustąpienie dolegliwości po spożyciu węglowodanów.
Diagnostyka hipoglikemii reaktywnej opiera się przede wszystkim na obserwacji objawów w powiązaniu z pomiarem stężenia glukozy we krwi. Lekarz może zlecić doustny test tolerancji glukozy (OGTT) lub test posiłkowy (MMTT), aby ocenić reakcję organizmu po jedzeniu. Czasem stosuje się również systemy ciągłego monitorowania glikemii (CGM), które pozwalają dokładniej śledzić wahania cukru w ciągu dnia.
Poniżej 70 mg/dl uznaje się za hipoglikemię i wymaga konsultacji lekarskiej, jeśli powtarza się regularnie.
Podczas epizodu hipoglikemii glukoza spada zwykle poniżej 70 mg/dl, często poniżej 55 mg/dl, gdy pojawiają się wyraźne objawy. Poza epizodami wartości mieszczą się w normie.
Najlepiej mierzyć poziom glukozy w trakcie występowania objawów hipoglikemii reaktywnej, zwykle 2–5 godzin po posiłku, aby wychwycić niskie stężenie glukozy. Pomiar na czczo zazwyczaj nie wykazuje odchyleń.
Najczęściej internista oraz endokrynolog. Bardzo ważną rolę odgrywa także dietetyk kliniczny.
Podstawą leczenia jest styl życia, zwłaszcza dieta i odpowiednio dobrana dietoterapia. Najczęściej zaleca się regularne posiłki co 3–4 godziny, produkty o niskim indeksie glikemicznym, źródła białka i zdrowych tłuszczów oraz unikanie cukrów prostych, alkoholu i nadmiaru kofeiny.
Hipoglikemia reaktywna nie jest samodzielną chorobą, lecz objawem zaburzeń metabolicznych, które można skutecznie kontrolować poprzez modyfikację diety i stylu życia. Jeśli hipoglikemia reaktywna wynika z innej choroby, jej objawy ustępują po wyleczeniu choroby podstawowej.
Przede wszystkim dietą i regularnymi posiłkami. Unika się cukrów prostych, alkoholu i dużych dawek kofeiny.
Tak, hipoglikemia może występować także u osób bez cukrzycy. Najczęściej pojawia się jako reaktywna hipoglikemia po posiłku, gdy organizm reaguje nadmiernym wydzielaniem insuliny, prowadząc do spadku poziomu glukozy we krwi.
U części osób tak, zwłaszcza po zmianie diety. U innych problem może powracać.
Tak – w większości przypadków to właśnie modyfikacje diety są podstawą leczenia hipoglikemii reaktywnej. Odpowiednio dobrane posiłki, regularność jedzenia i ograniczenie produktów o wysokim indeksie glikemicznym pomagają utrzymać stabilny poziom cukru we krwi i znacząco zmniejszyć ryzyko epizodów niedocukrzenia.
Ważne są posiłki oparte na produktach o niskim indeksie glikemicznym, źródłach białka, zdrowych tłuszczach i błonniku. Dobrze sprawdza się także model żywienia oparty na diecie śródziemnomorskiej, która sprzyja stabilizacji poziomu glukozy.
Warto unikać produktów powodujących szybki wzrost glukozy, a następnie gwałtowny spadek jej poziomu. Po takich posiłkach często pojawia się senność, rozdrażnienie i nagły głód.
Tak. W hipoglikemii reaktywnej produkty o wysokim indeksie glikemicznym szybciej podnoszą glukozę, co sprzyja późniejszemu „zjazdowi”. Wybieraj niski/średni indeks glikemiczny produktów, kontroluj porcje (liczy się też ładunek glikemiczny) i łącz węglowodany z białkiem oraz błonnikiem, aby stabilizować glikemię po posiłku.
Najskuteczniej poziom cukru we krwi podczas hipoglikemii można podnieść za pomocą tabletek z dekstrozą, żelu energetycznego zawierającego glukozę lub maltodekstrynę, a także słodkich napojów, np. coli.
Tak, ale w małych ilościach i najlepiej po posiłku bogatym w białko i błonnik.
Nie, ale ważny jest umiar i odpowiedni wybór. Zamiast wysokoprzetworzonych batonów czy ciast warto sięgnąć po zdrowsze alternatywy, takie jak owoce pod kruszonką, które łączą naturalną słodycz owoców z błonnikiem i wolniej uwalnianą energią.
Tak, ale z umiarem. Kofeina nie obniża bezpośrednio glukozy, ale nasila objawy adrenergiczne (kołatanie serca, drżenie, niepokój), przez co możesz silniej odczuwać „zjazd”. Pij kawę po posiłku lub z dodatkiem mleka/białka, unikaj picia na pusty żołądek i słodkich syropów; jeśli objawy się nasilają, rozważ kawę bezkofeinową lub ogranicz do 1–2 filiżanek/dzień.
Tak, banany mogą być spożywane przy hipoglikemii reaktywnej, szczególnie te mniej dojrzałe, gdyż zawierają wolniej przyswajalne cukry. Najlepiej jeść je w połączeniu z białkiem lub tłuszczem, co pomaga stabilizować poziom glukozy we krwi i zmniejsza ryzyko gwałtownego spadku cukru.
Tak, naturalny jogurt jest dobrym wyborem przy hipoglikemii reaktywnej, ponieważ zawiera białko, które pomaga stabilizować poziom glukozy we krwi. Najlepiej spożywać go z dodatkiem owoców, płatków owsianych lub orzechów, co dodatkowo spowalnia wchłanianie cukrów i zmniejsza ryzyko gwałtownego spadku glukozy.
Tak, bo dostarczają białka i tłuszczu, które stabilizują poziom cukru.
Aby zapobiegać spadkom cukru, najlepiej wybierać posiłki mieszane, łączące pełne ziarna, białko, warzywa i zdrowe tłuszcze. Tak skomponowany posiłek spowalnia wchłanianie cukrów, zmniejszając ryzyko gwałtownego spadku glukozy, co jest szczególnie ważne przy hipoglikemii reaktywnej.
Może być wyzwaniem z powodu nasilonego głodu i potrzeby szybkich węglowodanów, ale przy dobrze zaplanowanej dietoterapii redukcja masy ciała jest jak najbardziej możliwa.
Trzeba utrzymywać umiarkowany deficyt kaloryczny i unikać dużych wahań cukru, stosując posiłki o niskim IG.
Do najczęstszych błędów dietetycznych przy hipoglikemii reaktywnej należą spożywanie nadmiernej ilości szybko przyswajalnych węglowodanów, niewystarczająca podaż białka i błonnika pokarmowego oraz zbyt długie odstępy między posiłkami, które mogą prowadzić do wahań poziomu glukozy we krwi.
Tak. W ramach szkoleń dietetycznych dla firm pracownicy uczą się, jak komponować posiłki wspierające stabilny poziom glukozy, co zmniejsza ryzyko nagłych spadków energii i senności w pracy.
Jeśli objawy hipoglikemii reaktywnej powtarzają się mimo prób zmiany stylu życia, dobrze skorzystać z profesjonalnego wsparcia. Konsultacja żywieniowa pozwala dopasować dietę indywidualnie i nauczyć się praktycznych sposobów radzenia sobie z wahaniami cukru.
Może Cię również zainteresować:
2025-09-18
Spadek energii po lunchu? Jak dieta w pracy poprawia koncentrację i produktywność
To, co masz na talerzu, w dużym stopniu decyduje o tym, jak funkcjonujesz w biurze. Dieta…
2025-03-20
Jak dieta i styl życia wpływają na Twoją odporność?
Układ odpornościowy, czyli naturalna tarcza ochronna Twojego organizmu, pełni kluczową…
2025-02-24
Dieta śródziemnomorska – odkryj zasady i produkty najzdrowszej kuchni świata!
Dieta śródziemnomorska wpływa nie tylko na zdrowie, ale także na sposób myślenia o…
 PL (PLN)
PL (PLN) EN (GBP)
EN (GBP) EN (EUR)
EN (EUR)